L’hémorragie cérébrale

Résumé
Parmi les différents types d’accidents vasculaires cérébraux, l’hémorragie cérébrale constitue l’une des formes les plus graves. Pourtant, la prise en charge des patients en phase aiguë de l’hémorragie se heurte toujours à plusieurs obstacles : (1) Il n’existe actuellement aucune classification systématique des hémorragies cérébrales. (2) La stratégie du bilan diagnostique en phase aiguë de l’hémorragie n’a pas encore été standardisée. (3) Nos moyens d’intervention thérapeutique restent limités. (4) Pour certaines pathologies neurovasculaires à risque hémorragique (anévrismes, malformations artérioveineuses, cavernomes cérébraux), le bénéfice d’une intervention préventive préalablement à tout signe de rupture reste parfois incertain.
L’évolution récente vers une classification étiologique, la mise en place d’un bilan étiologique standardisé, ainsi que les grandes lignes des nouvelles stratégies thérapeutiques - dont l’abaissement rapide de la pression artérielle en phase aiguë de l’hémorragie cérébrale - seront illustrés dans le cadre de cette présentation.
L’hémorragie cérébrale : un type d’AVC à haut risque
Au sein des sociétés occidentales, les accidents vasculaires cérébraux (AVC) représentent la troisième cause de mortalité et la première cause d’invalidité. Parmi les différents types d’AVC, l’hémorragie cérébrale constitue l’une des formes les plus graves avec une mortalité qui varie de 30 et 50% dans les 30 premiers jours et une charge lourde de déficits neurologiques à long terme.[1] Dans nos populations vieillissantes, le taux annuel d’hémorragies augmente progressivement, ce qui est en partie lié à la prescription de plus en plus fréquente de traitements anticoagulants. [2]
Parmi les facteurs de risques les plus fréquents, on trouve l’hypertension artérielle (60-70% des cas), mais aussi l’abus d’alcool, le tabagisme ainsi que d’autres prédispositions structurelles comme l’angiopathie amyloïde. [3, 4, 5, 6]
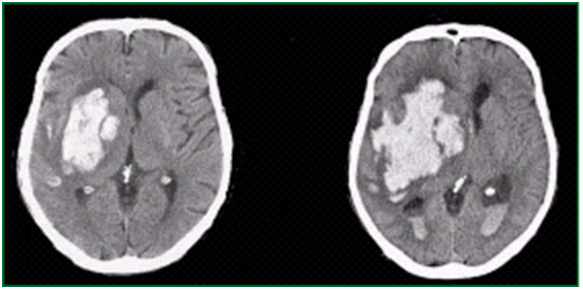
Au cours des premières 24 heures d’une hémorragie cérébrale spontanée, dans 38% des cas, le volume de l'hématome progresse d'au moins un tiers. [7] Cette progression de l'hématome est directement associée à la mortalité en phase aiguë et à la morbidité à long terme (Figure 1). [8, 9]
Le bilan diagnostique
Chez beaucoup de patients, la prise en charge de l’hémorragie cérébrale doit être définie par la pathologie sous-jacente, raison pour laquelle il est indispensable de réaliser un bilan étiologique en phase aiguë. L’imagerie diagnostique moderne inclut le scanner et l’angio-scanner cérébral, l’IRM et l’ARM cérébrale ainsi que l’artériographie cérébrale par cathétérisme artériel.
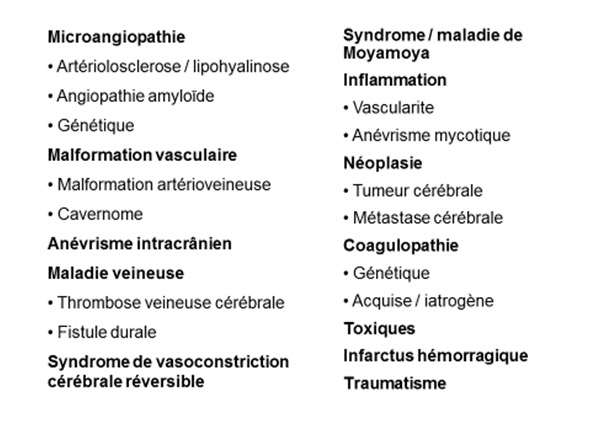
Les potentielles pathologies vasculaires sous-jacentes sont variées et peuvent se situer au niveau artériel (par exemple, microangiopathie cérébrale, anévrisme, syndrome de vasoconstriction cérébral réversible, moya-moya, etc.), du côté veineux (thrombose veineuse cérébrale, cavernome cérébral, etc), ou à la jonction des deux systèmes (malformation artérioveineuse, fistule durale). L’hémorragie peut également compliquer une autre pathologie sous-jacente, comme un infarctus cérébral (par transformation hémorragique secondaire), une lésion néoplasique, ou une maladie systémique (troubles de l’hémostase, endocardite, etc.). La Figure 2 résume la diversité des différentes pathologies sous-jacentes.
La sensitivité et la spécificité des différents examens radiologiques (scanner, angioscanner, IRM, angio-IRM, artériographie cérébrale) est l’objet de plusieurs études actuellement en cours.
Traitement aigu de l’hémorragie cérébrale
Comme pour tout AVC, la prise en charge initiale a une incidence directe sur le pronostic du patient :
Devant la morbi-mortalité élevée, l’hémorragie cérébrale est une urgence à la fois diagnostique et thérapeutique. Une hospitalisation en unité neurovasculaire ou réanimation diminue la morbi-mortalité de façon significative, et permet la surveillance et le traitement des paramètres vitaux (tension artérielle, saturation, fonction cardiaque, glycémie) et cliniques (vigilance, signes d’hypertension intracrânienne, crises épileptiques secondaires). [10, 11]
a) Evacuation chirurgicale
L’évacuation chirurgicale de l'hématome est réalisée au cas par cas, mais sans preuve scientifique d’un quelconque bénéfice: évacuation par craniotomie ouverte ou par voie endoscopique sous contrôle stéréotaxique. L’étude internationale STICH a inclus un total de plus de 1000 patients et a comparé l’évacuation chirurgicale précoce à la prise en charge médicale conservative dans les 72 heures d’une hémorragie cérébrale sus-tentorielle spontanée (sans malformation vasculaire sous-jacente). [12] Le choix de la méthode chirurgicale était laissée à l’appréciation des équipes neurochirurgicales qui dans la majorité des cas (77%) ont opté pour la craniotomie. L’étude n’a pas permis de montrer de différence entre la chirurgie et le traitement médical, ni en ce qui concerne la mortalité, ni en ce qui concerne la dépendance fonctionnelle à distance de 6 mois. Il en est allé de même pour l’étude STICH II (n=597 patients avec hématome lobaire de moins de 12 heures) au sein de laquelle aucun bénéfice en morbi-mortalité n’a été démontré pour la chirurgie. [13] Une autre étude évaluant la chirurgie « minimalement invasive » sur l’hématome est actuellement en cours, [14] une étude évaluant l’hémicrâniectomie décompressive après une hémorragie sus-tentorielle est en préparation. [15]
b) Traitement médicamenteux
1. Traitement hémostatique
Dans une étude randomisée (phase II) sur la tolérance et l’efficacité, des résultats prometteurs dans l’administration très précoce (< 4 heures après le début des signes cliniques) du facteur VII activé recombinant (FVIIa) ont été rapportés. [16] La progression du volume de l’hémorragie était nettement moindre dans le groupe traité par rapport au groupe placebo avec même une efficacité significative sur les critères cliniques de dépendance ou de mortalité. Néanmoins, une étude de phase III de confirmation n’a pas retrouvé d’effet favorable sur l’évolution clinique. [17]
D’autres traitements hémostatiques sont actuellement en cours d’évaluation, [18] y-compris la transfusion de plaquettes chez des patients victimes d’une hémorragie cérébrale aiguë dans le contexte d’un traitement antiplaquettaire en cours. [19] En attendant les résultats des études en cours, le traitement hémostatique ne peut pas être recommandé comme traitement pour l’hémorragie cérébrale aiguë. [11]
2. Traitement anti-œdèmateux
Malgré le mauvais pronostic de l’hypertension intracrânienne post-hémorragique, peu d’études randomisées ont évalué le bénéfice d'un traitement anti-œdèmateux : l'intérêt des corticoïdes a été évalué dans deux essais, [20, 21] le glycérol dans un essai [22] et l'hémodilution dans un autre. Aucun de ces essais n'a pu démontrer un bénéfice par rapport au placebo. De plus, tous ces produits ont causé des effets indésirables parfois graves. Ces traitements ne pourront donc pas être recommandés. [11]
3. Traitement antihypertenseur
Plusieurs études non contrôlées ont suggéré l'existence d'une corrélation directe entre les chiffres tensionnels artériels et le risque d’une détérioration neurologique chez les patients hospitalisés pour hémorragie intracérébrale spontanée. [23, 24] Les résultats de l’étude randomisée pilote INTERACT montraient que chez des patients traités par antihypertenseur moins de 6h après la survenue des symptômes de l’hémorragie cérébrale (tension artérielle systolique cible <140mmH), la progression du volume de l’hématome était moindre par rapport au groupe contrôle. [25] Finalement, l’étude INTERACT 2 (essai randomisé international de n=2839 patients) a mis en évidence une forte tendance d’amélioration de la morbi-mortalité (Odds Ratio 0.87; 95% intervalle de confiance 0.75 à 1.01; p=0.06) chez des patients traités par abaissement rapide de la tension artérielle systolique (tension cible < 140mmHg en <60min) ainsi qu’une une amélioration significative de l’évolution neurologique sur l’échelle de Rankin à 3 mois (Odds Ratio 0.87; 95% intervalle de confiance 0.77 à 1.00; P=0.04). [26] Dans une analyse secondaire, l’évolution neurologique dépendait étroitement de l’efficacité du traitement antihypertenseur durant les premières 24 heures, mais aussi de la stabilisation des chiffres tensionnels durant la première semaine d’hospitalisation. [27]. Les patients traités activement par anti-hypertenseurs en phase aiguë montraient également une amélioration dans leur qualité de vie 3 mois après l’hémorragie. [26]
En attendant les résultats d’un autre essai randomisé en cours, les recommandations actuelles favorisent en cas d’hémorragie cérébrale aiguë l’application immédiate d’un traitement anti-hypertenseur avec une tension systolique cible tension cible en dessous de 140mmHg en moins de 60 minutes. [11]
Conclusion
Durant longtemps, l’hémorragie cérébrale a reçu moins d’attention que la prise en charge de l’AVC ischémique. Une classification étiologique précise permettra la mise en place d’un bilan étiologique standardisé et le développement de nouvelles stratégies thérapeutiques. Comme pour tous les cas d’AVC, tout patient victime d’une hémorragie cérébrale aiguë doit être hospitalisé au sein d’une unité neurovasculaire ce qui permettra l’installation rapide d’un traitement anti-hypertenseur efficace.
Annexes
Figure 1°: Prise de volume progressive d’un hématome cérébral en phase aiguë du saignement
Tomodensitométrie cérébrale initiale Tomodensitométrie de contrôle (24h)
Figure 2° : Diagnostique étiologique différentiel des hémorragies cérébrales.
Modifié selon [28]
Références bibliographiques
[1] Sacco RL, Mayer SA. Epidemiology of intracerebral hemorrhage. In: Feldmann E, eds. Intracerebral hemorrhage. New York: Futura Publishing Co; 1994: 3–23.
[1] Steiner T, Rosand J, Diringer M: Intracerebral hemorrhage associated with oral anticoagulant therapy: current practices and unresolved questions. Stroke 2006;37:256-262.
[1] Thrift AG, McNeil JJ, Forbes A, Donnan GA. Three important subgroups of hypertensive persons at greater risk of intracerebral hemorrhage. Hypertension 1998; 31: 1223–29.
[1] Brott T, Thalinger K, Hertzberg V. Hypertension as a risk factor for spontaneous intracerebral hemorrhage. Stroke 1986; 17: 1078–83.
[1] Viswanathan A, Chabriat H: Cerebral microhemorrhage. Stroke 2006;37:550-555.
[1] Gebel JM, Broderick JP. Intracerebral hemorrhage. Neurol Clin 2000; 18: 419–38.
[1] Brott T, Broderick J, Kothari R, et al. Early hemorrhage growth in patients with intracerebral hemorrhage.
Stroke. 1997; 28: 1-5
[1] Flaherty ML, Haverbusch M, Sekar P, et al. Long-term mortality after intracerebral hemorrhage. Neurology 2006;66:1182-1186.
[1] Davis SM, Broderick J, Hennerici M, et al. Recombinant Activated Factor VII Intracerebral Hemorrhage Trial Investigators. Hematoma growth is a determinant of mortality and poor outcome after intracerebral hemorrhage. Neurology. 2006;66:1175-1181.
[1] Langhorne P, Fearon P, Ronning OM, et al. Stroke Unit Trialists Collaboration. Stroke unit care benefits patients with intracerebral hemorrhage: systematic review and meta-analysis. Stroke. 2013;44:3044-9.
[1] Steiner T, Al-Shahi Salman R, Beer R, et al. European Stroke Organisation (ESO) guidelines for the management of spontaneous intracerebral hemorrhage. Int J Stroke. 2014; 9:840-55.
[1] Mendelow AD, Gregson BA, Fernandes HM, et al. Early surgery versus initial conservative treatment in patients with spontaneous supratentorial intracerebral haematomas in the International Surgical Trial in Intracerebral Haemorrhage (STICH): a randomised trial. Lancet. 2005;365:387-397.
[1] Mendelow AD, Gregson BA, Rowan EN, Murray GD, Gholkar A, Mitchell PM; STICH II Investigators. Early surgery versus initial conservative treatment in patients with spontaneous supratentorial lobar intracerebral haematomas (STICH II): a randomised trial. Lancet. 2013;382:397-408.
[1] Minimally Invasive Surgery Plus rtPA for Intracerebral Hemorrhage Evacuation (MISTIE). http://www.clinicaltrials.gov/ct/show/NCT00224770
[1] http://www.neurovasc.ch/files/Kongresse/Flyer_Swiss-Stroke-Meeting-2014_final_def_detail_program.pdf
[1] Mayer SA, Brun NC, Begtrup K, et al. FAST Trial Investigators. Efficacy and safety of recombinant activated factor VII for acute intracerebral hemorrhage. N Engl J Med. 2008;358:2127-37.
[1] Mayer SA, Brun NC, Begtrup K, et al. Recombinant Activated Factor VII Intracerebral Hemorrhage Trial Investigators. Recombinant activated factor VII for acute intracerebral hemorrhage. N Engl J Med. 2005;352:777-785.
[1] You H, Al-Shahi R. Haemostatic drug therapies for acute primary intracerebral haemorrhage. Cochrane Database Syst Rev. 2006;3:CD005951
[1] de Gans K, de Haan RJ, Majoie CB, et al. PATCH Investigators. PATCH: platelet transfusion in cerebral haemorrhage: study protocol for a multicentre, randomised, controlled trial. BMC Neurol. 2010 Mar 18;10:19.
[1] Tellez H, Bauer RB. Dexamethasone as treatment in cerebrovascular disease. 1. A controlled study in intracerebral hemorrhage. Stroke. 1973;4:541-6.
[1] Poungvarin N, Bhoopat W, Viriyavejakul A, et al. Effects of dexamethasone in primary supratentorial intracerebral hemorrhage. N Engl J Med. 1987;316:1229-33.
[1] Yu YL, Kumana CR, Lauder IJ, et al. Treatment of acute cerebral hemorrhage with intravenous glycerol. A double-blind, placebo-controlled, randomized trial. Stroke. 1992;2:967-71.
[1] Fogelholm R, Avikainen S, Murros K Prognostic Value and Determinants of First-Day Mean Arterial Pressure in Spontaneous Supratentorial Intracerebral Hemorrhage. Stroke. 1997;28:1396-1400.
[1] Dandapani BK, Suzuki S, Kelley RE, Reyes-Iglesias Y, Duncan RC,. Relation Between Blood Pressure and Outcome in Intracerebral Hemorrhage Stroke 1995;26:21-24.
[1] Anderson CS, Huang Y, Wang JG, Arima H, Neal B, Peng B, Heeley E, Skulina C, Parsons MW, Kim JS, Tao QL, Li YC, Jiang JD, Tai LW, Zhang JL, Xu E, Cheng Y, Heritier S, Morgenstern LB, Chalmers J; INTERACT Investigators. Intensive blood pressure reduction in acute cerebral haemorrhage trial (INTERACT): a andomised
pilot trial. Lancet Neurol. 2008;7:391-9.
[1] Anderson CS, Heeley E, Huang Y, et al. INTERACT2 Investigators. Rapid blood-pressure lowering in patients with acute intracerebral hemorrhage. N Engl J Med. 2013;368:2355-65.
[1] Manning L, Hirakawa Y, Arima H, et al. Blood pressure variability and outcome after acute intracerebral haemorrhage: a post-hoc analysis of INTERACT2, a randomised controlled trial. Lancet Neurol. 2014;13:364-73.
[1] Al-Shahi Salman R, Labovitz DL, Stapf C. Spontaneous intracerebral haemorrhage. BMJ. 2009;339:b2586.
Pour en savoir plus
Ce texte sera présenté mardi 18 novembre à l'académie de Médecine
Descripteur MESH : Patients , Classification , Thérapeutique , Risque , Malformations artérioveineuses , Malformations , Pression , Pression artérielle , Grandes lignes , Rupture , Mortalité , Hémorragie , Hémorragie cérébrale , Hématome , Placebo , Essais , Hypertension artérielle , Pronostic , Craniotomie , Accident vasculaire cérébral , Confiance , Infarctus cérébral , Sociétés , Vie , Vasoconstriction , Plaquettes , Transfusion de plaquettes , Thrombose veineuse , Qualité de vie , Réanimation , Thrombose , Tabagisme , Syndrome , Glycémie , Accidents , Amyloïde , Anticoagulants , Cathétérisme , Crises épileptiques , Endocardite , Facteur VII , Fistule , Patients hospitalisés , Glycérol , Hémodilution , Hémostatiques , Hospitalisation , Incidence , Infarctus , Maladie