NANOBIOTIX :démarre un essai clinique de phase I/II dans les cancers primitifs t métastatiques du foie avec son produit NBTXR3
Paris, France, le 1 er juillet 2015 - NANOBIOTIX (Euronext: NANO - ISIN: FR0011341205) , société française pionnière en nanomédecine développant NanoXray, une approche thérapeutique révolutionnaire pour le traitement local du cancer, a reçu l'autorisation de démarrer un essai clinique de phase I/II pour les cancers du foie avec le produit leader de son pipeline NanoXray, NBTXR3.
-
L'ANSM a donné son autorisation pour commencer un essai clinique dans deux cancers à très grande incidence globale (plus de 1,5 million de patients par an);
-
Quatrième et cinquième indications, après le Sarcome des Tissus Mous, le cancer de la Tête et du Cou et le cancer du Rectum représentant une expansion significative du potentiel d'utilisation du produit NBTXR3;
-
Stratégie de développement construite avec les paramètres d'évaluation les plus reconnus en oncologie comme la Survie Globale et la Qualité de Vie.
L'Agence Nationale de Sécurité du Médicament et des produits de santé (ANSM) a donné son feu vert pour initier un essai clinique de Phase I/II dans deux nouvelles populations de cancer - le carcinome hépatocellulaire (HCC) et les métastases du foie - dans le cadre du développement clinique de NBTXR3. L'étude de phase I/II, internationale, non randomisée, ouverte, évaluera le produit NBTXR3 activé par radiothérapie de haute précision délivrée par hypo-fractionnement (radiothérapie externe stéréotaxique - SBRT), représentant la radiothérapie la plus sûre et la plus moderne pour le traitement des tumeurs malignes du foie. Le démarrage de cet essai clinique a été supporté par un vaste programme préclinique spécifique pour ces cancers. La faisabilité de cette approche et la tolérance du produit NBTXR3 ont été démontrées chez les animaux. Ce projet fait partie du consortium de nanomédecine NICE, financé par Bpifrance.
Les cancers du foie sont des pathologies difficiles à traiter. La plupart des patients, atteints soit de HCC soit de métastases hépatiques ne peuvent bénéficier de la chirurgie et ont peu ou pas d'options thérapeutiques.
Il est intéressant de noter que de précédents essais cliniques ont montré une corrélation directe entre des doses plus élevées de radiothérapie et l'amélioration des bénéfices cliniques, y compris la survie. Cependant, l'application de doses élevées est difficilement réalisable dans le foie (organe vital). La SBRT a démontré son efficacité seulement chez un sous-ensemble spécifique de la population ayant de petites tumeurs. L'obtention d'une réponse complète est un événement rare et le contrôle local est compromis pour les grandes tumeurs, les métastases et le HCC avec une thrombose tumorale de la veine porte ce qui engendre une Survie Sans Progression (PFS) et Survie Globale courtes (OS). Le produit NBTXR3 lorsqu'il est activé par radiothérapie, permet un dépôt de doses d'énergie élevées (radioenhancement) au sein de la tumeur. L'administration de NBTXR3 devrait augmenter significativement la dose d'énergie intratumorale et pourrait permettre une meilleure destruction afin d'améliorer le bénéfice pour les patients en termes de réduction tumorale, de contrôle local et de survie globale.
Elsa Borghi, CMO de Nanobiotix commente: « Cet essai clinique a été conçu pour évaluer la sécurité et l'efficacité préliminaire de NBTXR3 dans 3 indications potentielles (deux types d'HCC et les métastases hépatiques). La structure et le nombre de patients par groupe ont été déterminés sur la base d'hypothèses statistiques en comparaison avec la littérature scientifique afin d'obtenir des résultats rapides qui dérisquent le projet. Cette stratégie pourrait permettre une démonstration d'efficacité et ouvrir une voie rapide vers le marché».
Le but de cette investigation clinique (Phase I et II) est d'introduire l'utilisation de NBTXR3 activé par SBRT chez des patients atteints de cancers du foie qui ont besoin d'une stratégie de traitement alternative lorsque les soins standards ne peuvent pas être utilisés ou n'existent pas:
-
Des patients atteints de cancers du foie avec une maladie hépatique sous-jacente qui rendent irréalisables certains traitements incluant la chimiothérapie, les produits biologiques
-
Des patients chez qui les traitements locaux disponibles sont reconnus comme inefficaces comme par exemple pour les patients ayant des tumeurs de grandes tailles
-
Des patients atteints de HCC avec thrombose tumorale de la veine porte
-
Des patients atteints de métastases hépatiques inopérables
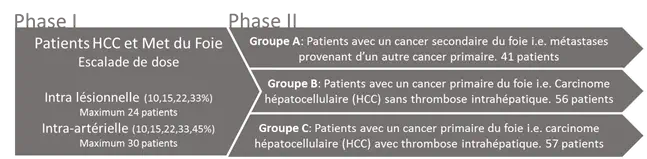
Phase I : Escalade de dose, évaluation de la sécurité et détermination de la dose recommandée (Volume) pour la partie Phase II
A partir d'un algorithme clinique classique, 3 différents types de tumeurs seront traitées avec une escalade de dose par niveau du produit NBTXR3. Cette étape de l'étude vise à déterminer la dose recommandée, qui sera ensuite évaluée au cours de la Phase II avec une stratégie plus spécifique.
Phase II : Evaluation de l'efficacité et de la sécurité d'utilisation de la dose recommandée (volume)
La Phase II comprend l'évaluation de NBTXR3 au sein de 3 groupes de patients ciblés, qui seront étudiés simultanément. Leur définition a été basée sur les caractéristiques de la maladie des patients, à savoir:
Groupe A : Patients avec un cancer secondaire du foie i.e. métastases provenant d'un autre cancer primaire.
Groupe B : Patients avec un cancer primaire du foie i.e. Carcinome hépatocellulaire (HCC) sans thrombose intrahépatique tumorale du tronc de la veine porte.
Groupe C : Patients avec un cancer primaire du foie i.e. carcinome hépatocellulaire (HCC) avec thrombose intrahépatique tumorale du tronc de la veine porte.
Le recrutement des patients dans chaque groupe débutera une fois que la dose recommandée sera déterminée au sein de la précédente Phase I.
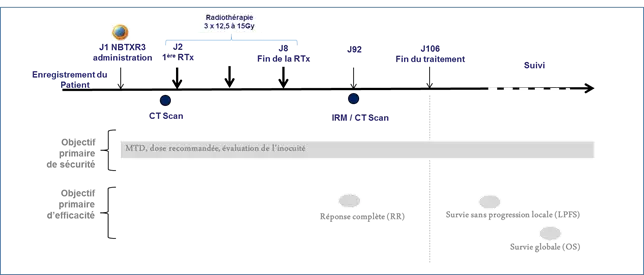
L'innocuité et la tolérance seront évaluées pour tous les patients par la surveillance des événements indésirables pouvant intervenir pendant le traitement et post-traitement.
L'efficacité primaire sera évaluée à travers le taux de réponse complète (CRR) selon mRECIST et d'autres biomarqueurs spécifiques. La survie sans progression locale (LPFS) ainsi que la survie globale (OS) seront évaluées en tant qu'objectifs secondaires.
Le protocole de traitement des patients est résumé ci-dessous.
***
A propos du plan de développement clinique de NBTXR3
Le cancer est la principale cause de décès dans le monde, représentant 8,2 millions de décès en 2012. Il est anticipé que le nombre annuel de cas de cancer augmentera de 14 millions en 2012 à 22 millions dans les deux prochaines décennies (OMS).
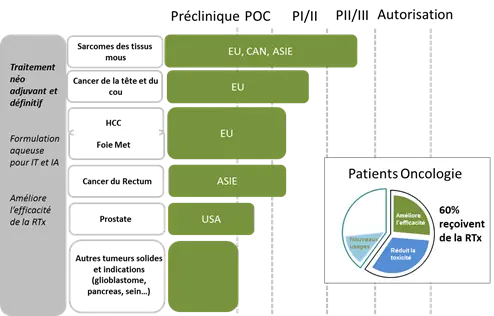
La radiothérapie est le deuxième traitement le plus utilisé dans le traitement du cancer, devant les produits pharmaceutiques. En moyenne, 60% de tous les patients atteints de cancer nouvellement diagnostiqués recevront une radiothérapie à une étape de leur parcours de soin. La radiothérapie a cependant des limitations à cause de l'irradiation des tissus sains entourant les tumeurs.
La technologie NanoXray est basée sur l'utilisation des propriétés physiques de nanoparticules d'oxyde d'hafnium et est destinée à améliorer l'efficacité de la radiothérapie pour un grand nombre d'indications cancéreuses.
Les nanoparticules sont conçues pour pénétrer dans les cellules tumorales et, lors de l'activation par une dose standard de rayonnement, elles émettent de grandes quantités d'électrons conduisant à la génération de radicaux libres qui détruisent les cellules cancéreuses (même mode d'action que la radiothérapie mais largement amplifié). Les nanoparticules améliorent ainsi la radiothérapie en amplifiant localement la dose létale d'énergie dans la tumeur sans augmenter la dose traversant les tissus sains environnants.
La technologie NanoXray pourrait être utilisée soit pour augmenter la dose dans la tumeur (avec l'intention d'augmenter l'aspect curatif de la radiothérapie) en gardant la totalité de la dose habituellement administrée au patient, soit pour réduire la toxicité potentielle des rayons X en réduisant la dose totale administrée aux patients tout en gardant une efficacité équivalente ou supérieure.
Nanobiotix développe trois produits différents qui peuvent être administrés soit par injection directe dans la tumeur (NBTXR3), par injection intraveineuse (NBTX-IV) ou par application directe dans la cavité tumorale après une intervention chirurgicale (NBTX-TOPO). Le choix du produit dépendra du type de tumeur et des besoins cliniques spécifiques du patient. Ces trois produits ont été développés à partir de nanoparticules d'oxyde d'hafnium (HfO 2 ) avec des revêtements de surfaces différents. Les produits NanoXray sont compatibles avec les méthodes actuelles de radiothérapie: l'équipement et les protocoles, ainsi qu'avec les équipements plus anciens ou toutes les thérapies basées sur les rayonnements (curiethérapie, protonthérapie...).
L'objectif à court terme de la société est de développer NBTXR3 dans les premières indications où la dose standard administrée aux patients est maintenue avec l'intention d'augmenter l'efficacité. Le pipeline de la société comprend actuellement: un essai d'enregistrement dans le sarcome des tissus mous (STS), un essai de phase I/II dans les cancers de la tête et du cou, un essai de phase I/II dans les cancers du foie métastatique, un essai de phase I/II dans les carcinomes hépatocellulaires (HCC) et un essai de phase I/II dans le cancer du rectum (par PharmaEngine). Ces essais cliniques sont en cours en Europe, en Asie et au Canada. La stratégie de l'entreprise comprend également un essai dans le cancer de la prostate qui devrait être lancé plus tard aux États-Unis.
Ces premières indications développées ne représentent qu'une petite partie des applications potentielles de ces produits. D'autres indications, concernant NBTXR3 (par exemple dans le but de réduire la toxicité de la radiothérapie) ou concernant les autres produits du pipeline (NBTX TOPO, NBTX IV) seront développées ultérieurement.
A propos de NANOBIOTIX - www.nanobiotix.com/fr
Nanobiotix, spin-off de l'Université de Buffalo, SUNY, a été créée en 2003. Société pionnière et leader en nanomédecine, elle a développé une approche révolutionnaire dans le traitement local du cancer. La société concentre son effort sur le développement de son portefeuille de produits entièrement brevetés, NanoXray, innovation reposant sur le mode d'action physique des nanoparticules qui, sous l'action de la radiothérapie, permettent de maximiser l'absorption des rayons X à l'intérieur des cellules cancéreuses. Les produits NanoXray sont compatibles avec les traitements de radiothérapie standards et visent à traiter potentiellement une grande variété de cancers (sarcome des tissus mous, cancer du sein, cancer du foie, cancer de la tête et du cou, glioblastome, prostate...) et cela par de multiples voies d'administration.
NBTXR3, le produit NanoXray en tête de développement, est actuellement testé au cours de plusieurs études cliniques chez des patients atteints de: Sarcome des Tissus Mous localement avancé, cancer de la Tête et du Cou localement avancé, cancer du Rectum (PharmaEngine) et cancers du foie. La société a établi un partenariat avec PharmaEngine pour le développement clinique et la commercialisation de NBTXR3 en Asie-Pacifique.
Nanobiotix est entrée en bourse en octobre 2012. La société est cotée sur le marché réglementé d'Euronext à Paris (Code ISIN: FR0011341205, code mnemonic Euronext: NANO, code Bloomberg: NANO:FP). Installée à Paris, Nanobiotix a ouvert une filiale dans la région de Boston aux Etats-Unis.
Contacts
| Nanobiotix | ||
Sarah Gaubert Directrice de la Communication et des Affaires Publiques 33 (0)1 40 26 07 55 contact@nanobiotix.com |

|
|
| Relations presse | ||
France - New Cap Annie-Florence Loyer 33 (0)6 88 20 35 59 afloyer@newcap.fr |
Hors de France - Instinctif Partners Melanie Toyne Sewell 44 (0) 207 457 2020 nanobiotix@instinctif.com |
|
Avertissement
Le présent communiqué contient des déclarations prospectives relatives à Nanobiotix et à ses activités. Nanobiotix estime que ces déclarations prospectives reposent sur des hypothèses raisonnables. Cependant, aucune garantie ne peut être donnée quant à la réalisation des prévisions exprimées dans ces déclarations prospectives qui sont soumises à des risques dont ceux décrits dans le rapport financier annuel 2014 de Nanobiotix sur le site internet de la Société ( www.nanobiotix.com ), et à l'évolution de la conjoncture économique, des marchés financiers et des marchés sur lesquels Nanobiotix est présente. Les déclarations prospectives figurant dans le présent communiqué sont également soumises à des risques inconnus de Nanobiotix ou que Nanobiotix ne considère pas comme significatifs à cette date. La réalisation de tout ou partie de ces risques pourrait conduire à ce que les résultats réels, conditions financières, performances ou réalisations de Nanobiotix diffèrent significativement des résultats, conditions financières, performances ou réalisations exprimés dans ces déclarations prospectives.
Le présent communiqué et les informations qu'il contient ne constituent ni une offre de vente ou de souscription, ni la sollicitation d'un ordre d'achat ou de souscription des actions de Nanobiotix dans un quelconque pays.
The issuer of this announcement warrants that they are solely responsible for the content, accuracy and originality of the information contained therein.
Source: NANOBIOTIX via GlobeNewswire
Descripteur MESH : Foie , Essai clinique , Patients , Radiothérapie , Nanomédecine , France , Thérapeutique , Survie , Tumeurs , Tissus , Tête , Nanoparticules , Thrombose , Sécurité , Cou , Rectum , Cellules , Carcinome hépatocellulaire , Carcinome , Veine porte , Maladie , Rayons X , Prostate , Asie , Paris , Solutions , Intention , Technologie , Hafnium , Essais , Tronc , Statistiques , Tumeurs du sein , Tumeurs de la prostate , Soins , Santé , Objectifs , Rayonnement , Vie , Glioblastome , Animaux , Boston , Canada , Caractéristiques de la maladie , Cause de décès , Communication , Curiethérapie , Électrons , Europe , Radicaux libres


