Pollution de l’horloge interne par la lumière la nuit, un problème de santé publique
Yvan Touitou
yvan.touitou@chronobiology.fr
Unité de Chronobiologie, Fondation A. de Rothschild, Paris
Ce document a été présenté mardi 6 octobre 2015 à l'Académie de médecine
Introduction
L’auteur déclare ne pas avoir de liens d’intérêt avec le contenu de cet article
L’horloge interne localisée dans les noyaux suprachiasmatiques de l’hypothalamus antérieur est sous le contrôle de la lumière, principal synchroniseur. Au niveau de l’œil, les cellules ganglionnaires rétiniennes prennent en charge le signal lumineux grâce à un photorécepteur, la mélanopsine, sensible à la raie bleue (460-480 nm) du spectre lumineux. Le signal est ensuite transmis à l’horloge interne pour aboutir, après plusieurs relais, à la glande pinéale qui secrète la mélatonine, hormone clé considérée comme l’aiguille de l’horloge. La lumière, même de faible intensité comme celle apportée par les LED, tablettes ou téléphones portables, inhibe la sécrétion de mélatonine qui est l’hormone de l’obscurité. Un autre effet de lumière est d’avancer ou de retarder la phase du système circadien selon l’heure d’exposition. Cette notion de courbe de réponse de phase est conceptuellement importante et utile car elle est à la base de la remise à l’heure de l’horloge dans diverses situations de désynchronisation.
L’exposition à la lumière artificielle la nuit (LAN) peut avoir des effets délétères sur la santé en lien avec la désorganisation d’une horloge en conflit avec les signaux de l’environnement. En France et dans les pays industrialisés environ 75% de la population active travaillent dans des horaires atypiques c’est-à-dire en dehors des horaires diurnes classiques. Ainsi, 15,4 % de la population active en France est en travail posté ou de nuit. Des études épidémiologiques concordantes font état d’une augmentation modérée mais significative (50 à 100% en moyenne) du risque relatif de cancer du sein chez, en particulier, les infirmières exposées de façon chronique (3 à 20 ans selon les études) à la LAN, un nouvel agent de pollution. Il en de même du personnel navigant sur longs courriers bien que, dans ce cas, d’autres causes ne puissent être exclues (radiations…). D’autres effets délétères de la LAN, sont rapportés dans l’article. Les mécanismes proposés font intervenir l’inhibition de la sécrétion nocturne de mélatonine par la LAN et la privation de sommeil. Le Centre International de Recherche sur le Cancer a classé en 2007 le travail posté qui entraîne une désorganisation circadienne dans le groupe 2A des « cancérogènes probables ». Diverses contre-mesures (mélatonine, lumière, psychotropes..) sont à l’étude dans le but d’améliorer l’adaptation au travail posté et de nuit et neutraliser la pollution de l’horloge et sa désynchronisation par la LAN.
Le système circadien
Tous les mammifères, l’homme en particulier, présentent des rythmes qui s’étendent de la milliseconde (rythme ultradien dont la période est comprise entre la millisecondes et 20h) à l’année (rythme infradien dont la période est comprise entre 28h et un an) mais les rythmes circadiens dont la période est égale à 24 ± 4 heures sont sans conteste ceux qui ont été le plus étudiés dans la littérature [1]. Ces rythmes sont sous la dépendance d’une horloge interne considérée comme l’horloge principale située dans les noyaux suprachiasmatiques (SCN) de l’hypothalamus antérieur à côté de laquelle ont été identifiées des horloges périphériques présentes dans de nombreux tissus comme le foie, le rein, le cœur, la peau, la rétine… et capables de fonctionner de façon autonome [2,3]. Les interrelations possibles entre l’horloge principale localisée dans les SCN et les horloges périphériques sont encore mal connues et font l’objet de travaux actuels [4].
Le fonctionnement général du système circadien correspond à un ensemble complexe qui part de l’œil pour aboutir à la glande pinéale qui produit la mélatonine, neurohormone essentielle au fonctionnement de l’horloge. Au niveau de l’œil, les cellules ganglionnaires rétiniennes intrinsèquement photosensibles renferment un photorécepteur, la mélanopsine, sensible à la raie bleue de la lumière, dont le rôle est fondamental dans le fonctionnement du système circadien et l’entraînement des SCN. Il s’agit donc ici d’un système exclusivement rétinien impliqué dans des fonctions non visuelles, contrairement aux cônes et bâtonnets essentiels à la vision [5-8]. Le signal photique reçu par la rétine est transmis aux SCN par voie rétino-hypothalamique, puis par des voies multisynaptiques complexes au ganglion cervical supérieur pour aboutir à la glande pinéale (Figure 1) qui sécrète la mélatonine. La caractéristique essentielle de cette hormone est sa sécrétion nocturne, conséquence d’un message neuronal atteignant la glande pinéale via les nerfs sympathiques périphériques qui l’innervent ; ce message est amorcé dans le SCN quand les neurones sont soustraits à l’effet inhibiteur de la lumière ce qui induit la libération de noradrénaline (NA) par les terminaisons nerveuses du système sympathique. La NA libérée intervient au niveau des récepteurs bêta-adrénergiques qui transmettent le stimulus au système adénylate cyclase d’où transférase, l’enzyme clé de la synthèse de mélatonine [in 9].
Contrôle du système circadien par la lumière
La lumière est le synchroniseur le plus puissant chez l’homme. Elle entraîne, jour après jour, l’horloge interne de l’homme sur 24 heures car la période endogène de l’horloge n’est pas exactement égale à 24 heures mais voisine de 24,2h. La synchronisation de l’horloge par la photopériode commence dès la vie fœtale chez les mammifères en relation avec la sécrétion de mélatonine maternelle [10].
La mélatonine est considérée comme l’aiguille de l’horloge car c’est elle qui transmet à l’organisme le signal de la lumière et de l’obscurité. La lumière contrôle la sécrétion de mélatonine et agit de manière différente sur la sécrétion de mélatonine en fonction de l’heure d’exposition, de l’intensité, du spectre lumineux et de la durée d’exposition. Lorsque l’exposition a lieu la nuit au moment du pic de sécrétion (02-03 h), la sécrétion de mélatonine est totalement inhibée pendant toute la durée d’exposition en raison de la neutralisation par la lumière de l’activité de l’enzyme clé de la synthèse de l’hormone, la N-acétyltransférase (NAT) [in 9]. Lorsque l’exposition a lieu le matin, l’horloge se met en avance de phase, le pic du rythme circadien de la mélatonine, par exemple, étant avancé dans le temps par rapport à sa localisation temporelle habituelle. Lorsque l’exposition a lieu en fin d’après-midi, l’horloge est en retard de phase ( le pic est retardé). Il y a ainsi une véritable courbe de réponse de phase (PRC ; Figure 2) conceptuellement très importante dans la mesure où elle est à l’origine du traitement des patients dont l’horloge est désynchronisée par une exposition à la lumière dans les créneaux horaires opportuns en fonction du sens (avance ou retard de phase) de la désynchronisation de ces patients [11,12].
L’effet de la lumière dépend également de ses caractéristiques d’intensité et de durée [13,14], comme de son spectre car la mélanopsine qui prend en relais le message photique dans la rétine est particulièrement sensible à la raie bleue de la lumière (longueur d’onde 460 nm) [5,15]. Même une intensité lumineuse faible, comme celle apportée avec la récente technologie des LED, par les écrans d’ordinateurs ou de télévisions, le téléphone portable ou les tablettes est capable d’agir sur l’horloge en entraînant un retard de phase, et de freiner la sécrétion de mélatonine [16]. Chez les adolescents, grands utilisateurs de toutes sortes de consoles à différentes heures de la journée y compris tard le soir, le retard de phase, souvent associé à terme à une dette de sommeil, est à l’origine de troubles de désynchronisation de l’horloge assimilés à une sorte de jet lag chronique encore appelé jet lag social, préjudiciable à leur santé [17].
Comme la lumière est la portion visible du spectre électromagnétique, la question s’est posée de savoir si d’autres longueurs d’onde étaient susceptibles également d’intervenir sur l’horloge et il a été montré que les champs magnétiques de basse fréquence (50 Hz) ou les radiofréquences n’entraînent pas chez l’homme, comme la lumière, d’effet de désynchronisation de l’horloge ni d’effets sur la sécrétion de la mélatonine, y compris chez les travailleurs exposés de façon chronique, jusqu’à 20 ans, aux champs magnétiques dans le cadre de leurs activités [18-21].
Désynchronisation du système circadien et horaires atypiques de travail
Dans tous les cas où le cycle lumière-obscurité est modifié, comme lors des vols transméridiens portant sur plus de trois fuseaux horaires [22,23], lors du travail posté et de nuit [24-28] ou en cas de cécité, l’horloge est en situation de désynchronisation dont l’importance est en lien avec la durée de la désynchronisation. La désynchronisation est donc un état dans lequel le temps biologique (l’horloge) et le temps astronomique (la montre) sont dissociés [29].
Pour répondre à des exigences de production (machines fonctionnant 24h/24), de coûts ou de sécurité particulière environ 15 à 20 % de la population active, en France comme en Europe, est constituée de travailleurs postés et/ou de nuit. En effet, dans nos sociétés modernes industrialisées les horaires standards de travail de 8 h à 17 h par exemple, 5 jours par semaine sont devenus minoritaires (25 %) par rapport aux horaires dits atypiques, non standards, comme le travail posté, le travail de nuit, le travail à mi-temps, le travail pendant les week-ends etc. dont l’ensemble est pratiqué actuellement par 75% de la population active. Les horaires atypiques de travail se retrouvent dans les métiers de services comme la santé, les transports et communications, la police, l’hôtellerie et restauration etc.
Sont donc considérés comme horaires atypiques de travail toutes les configurations de temps de travail se trouvant en dehors des horaires standards quotidiens usuels. Le travail posté et le travail de nuit sont ainsi partie intégrante des horaires atypiques. Les directives européennes (93/104/CE et 2003/88/CE) donnent la définition suivante du travail posté « tout mode d’organisation du travail en équipe selon lequel les travailleurs sont occupés successivement sur les mêmes postes de travail, selon un certain rythme, y compris le rythme rotatif, et qui peut être de type continu ou discontinu, entraînant pour les travailleurs la nécessité d’accomplir un travail à des heures différentes sur une période donnée de jours ou de semaines ».
Selon le code du travail, le travail de nuit est défini comme un travail ayant lieu entre 21h et 6 h du matin. Réglementairement, un travailleur de nuit est un travailleur qui effectue soit au moins trois heures de travail quotidien deux fois par semaine dans cet intervalle horaire, soit 270 heures sur une période de douze mois consécutifs.
La lumière artificielle la nuit, une nouvelle source de pollution
Dans la majorité des études réalisées à ce jour le travail posté et/ou de nuit a été montré comme délétère pour la santé des travailleurs sur lesquels ont été décrits de nombreux troubles tels les troubles du sommeil, gastro-intestinaux, neuropsychiques, cardio-vasculaires, ou encore l’apparition de cancer. Ces effets sont considérés comme liés à la perte de synchronisation entre l’horloge interne et son environnement, l’alternance lumière obscurité essentiellement.
Le Centre International de Recherche sur le Cancer (CIRC, IARC des anglo-saxons) souligne en 2007 qu’il y a « des preuves limitées de carcinogénicité du travail posté chez l’homme » mais qu’ « une association positive a été observée entre l’exposition au travail posté et le cancer pour laquelle une interprétation causale est considérée comme crédible mais le hasard, les biais, et des facteurs confondants ne peuvent pas être éliminés ». Le CIRC a donc classé le travail posté et/ou de nuit dans le groupe 2A des « cancérogènes probables » car ils « impliquent une désorganisation circadienne » [30,31].
La relation entre l’exposition à lumière lors du travail posté et/ou de nuit et l’apparition d’un cancer chez les travailleurs a été l’objet de nombreux travaux scientifiques [32]. L’ hypothèse du rôle de la lumière dans cet effet prend appui de façon indirecte sur les recherches montrant la diminution de la prévalence du cancer du sein chez les femmes aveugles avec cependant la réserve du faible nombre de cas étudiés [33-37] ; l’association positive avec l’éclairage domestique de la chambre la nuit, la réserve étant les biais d’usage dans ce type d’études liés au recueil d’informations déclaratives [38,39] ; la codistribution de l’éclairage extérieur et l’incidence plus élevée de 73% du cancer du sein observés dans deux études, l’une en Israel [40,41], l’autre en Corée du sud [42], dans les quartiers éclairés d’une ville par rapport à ceux qui ne le sont pas, ce qui a entraîné les différents auteurs à considérer la lumière comme un agent de pollution ; enfin le temps de sommeil associé dans des études prospectives à un risque plus faible [43] qui n’est cependant pas retrouvé dans une autre étude [44].
Cancer du sein
Deux études prospectives de cohortes ont porté sur les infirmières américaines (Nurse Health Study I et II) [45,46].
Dans la première étude, ont été retenues les infirmières ayant travaillé au moins 3 nuits par mois. 78 562 infirmières ont été ainsi suivies pendant 10 ans. Un cancer du sein a été retrouvé chez 2441 d’entre elles. L’étude indique que le risque de cancer du sein augmente avec le nombre d’années passé en poste de nuit et qu’il est significativement augmenté de 36% lorsqu’il y a au moins 3 nuits travaillées par mois pendant 30 années [45].
Dans la seconde étude des mêmes auteurs portant sur 115 022 infirmières suivies pendant 12 ans, avec un cancer du sein diagnostiqué chez 1352 d’entre elles, le risque relatif (RR) de cancer du sein était 1,79 chez les femmes ayant travaillé au moins 3 nuits pendant 20 ans [46]. Dans une étude cas-témoins portant sur 873 femmes travaillant de 19 h à 9 h au moins une fois par semaine pendant 10 ans, une augmentation significative du risque de 60% a été retrouvée [47]. Une étude cas-témoins danoise rétrospective portant sur 7565 femmes indique que les femmes travaillant de façon prédominante la nuit pendant plus de 6 ans ont une augmentation significative de 70 % du risque relatif de cancer du sein, avec une tendance à l’augmentation de l’Odd Ratio (OR) lorsque la durée du travail la nuit est elle-même augmentée [48,49]. Une étude norvégienne [50] rapporte dans une cohorte de 44853 infirmières une augmentation significative du risque de cancer du sein (OR=2,21) chez les infirmières ayant travaillé la nuit pendant plus de 30 ans.
Dans une étude ultérieure les mêmes auteurs décrivent une augmentation significative du risque chez les infirmières ayant travaillé au moins 5 ans avec au moins 6 nuits travaillées consécutives (OR 1,8 ; intervalle de confiance :1,1-2,8) ce qui suggère que le risque peut-être lié au nombre de nuits consécutives [51]. En France l’étude cas-témoins CECILE rapporte une élévation significative du risque de cancer du sein (OR = 1,40) chez les femmes ayant travaillé de nuit pendant au moins 4,5 ans, en particulier celles ayant pratiqué le travail de nuit avant leur première grossesse [52]. Au total, la plupart des études épidémiologiques sur le lien entre cancer du sein et travail posté ont rapporté une augmentation de l’ordre de 50 à 100% du risque de cancer du sein chez les femmes en poste de nuit [45-52], trois études cependant ne retrouvent pas ce lien [53-55], l’une d’entre elles portant sur un très petit nombre de cas [53]. Les études positives portant sur le risque de cancer sont souvent des études de cohortes d’infirmières en poste la nuit lorsqu’il s’agit de cancer du sein [46,49-51] ou d’opérateurs radio, par exemple, pour d’autres localisations [56]. Une méta-analyse conduite en 2005 sur le travail de nuit fait état d’une augmentation moyenne significative de 51 % du risque de cancer du sein chez la femme exposée de façon chronique à la lumière la nuit [57].
Cas particulier du personnel navigant
Un cas particulier de désorganisation circadienne est représenté par les personnels navigants qui effectuent régulièrement des vols transméridiens sur de nombreux fuseaux horaires, qui sont soumis aux effets de la lumière la nuit dans le cadre de leur travail, et qui subissent les effets des radiations ionisantes. Un certain nombre d’études ont été réalisées sur le risque de cancer du sein chez l’hôtesse de l’air travaillant sur long-courriers et traversant plusieurs fuseaux horaires. Toutes ont montré un RR significatif dont les valeurs extrêmes étaient comprises entre 1,2 et 5,4 selon les études[par exemple 58-60] alors que les études sur les équipages travaillant sur des vols domestiques ont montré moins d’effet [59,61].
Dans une étude portant sur huit pays européens la mortalité a été trouvée légèrement augmentée chez les hôtesses de l’air sans que cette augmentation soit en lien avec la durée de l’emploi [62], résultats confirmés dans une étude islandaise et une étude finlandaise [60,63]. Il faut souligner la difficulté dans ce type d’études concernant le personnel navigant de faire la part de ce qui revient aux effets d’une désynchronisation répétitive liée au passage de nombreux fuseaux horaires plusieurs fois par mois, aux effets de l’exposition à la lumière la nuit pendant les vols, ou encore aux effets des radiations ionisantes. Une méta-analyse sur l’incidence du cancer du sein chez les hôtesses de l’air fait le point sur la question [64].
Parallèlement, l’incidence du cancer de la prostate chez les pilotes et le personnel navigant masculin a fait l’objet d’un nombre relativement important d’études montrant une augmentation du risque qui, bien que significative, reste très modérée [par exemple 65-68].
Mécanismes des effets de l’exposition nocturne à la lumière artificielle
Mécanismes des effets de l’exposition nocturne à la lumière artificielle
Divers mécanismes ont été proposés pour expliquer les effets de la lumière dont deux paraissent essentiels : l’inhibition de la sécrétion nocturne de mélatonine par la lumière et la privation de sommeil qui impacte différents niveaux du métabolisme de l’organisme. Le premier mécanisme mis en avant est donc l’inhibition importante de la sécrétion de mélatonine lors d’une exposition à la lumière [69] qui entraîne chez les femmes en travail posté d’une part une augmentation des oestrogènes [70], important facteur de risque du cancer du sein [71] et d’autre part, la disparition des nombreux effets biologiques de l’hormone comme la fonction d’épuration des radicaux libres, l’inhibition de l’activité de l’aromatase, l’effet antioestrogènique par interaction avec les ER alpha, l’inhibition de l’activité de la télomérase, la réparation de l’ADN, la perturbation du système immunitaire et l’action oncostatique via la régulation du métabolisme de l’acide linoléique, promoteur de tumorigènèse mammaire chez l’homme et la souris [72].
De plus, les travailleurs postés et/ou de nuit ont une diminution quotidienne du temps de sommeil de 2 à 4 heures qui aboutit sur le long terme à une dette de sommeil. La privation de sommeil impacte fortement le système neuro-immuno-endocrinien qui joue un rôle important dans la régulation de la prolifération cellulaire et des défenses immunitaires incluant la production de cytokines [73-75]. Par ailleurs, le sommeil en journée est moins réparateur car il est de moins bonne qualité, morcelé, plus court et perturbé par la vie sociale extérieure. La privation de sommeil entraîne somnolence, diminution de l’attention et de la vigilance à l’origine d’un doublement du risque des accidents de la circulation, plus important lors des trajets aller avant la prise d’un poste du matin et lors des trajets retour après la fin d’un poste de nuit, et qui augmente avec des postes de travail dont la durée est supérieure à 10h. Il est intéressant de noter que la meilleure adaptation aux travail posté est lié au chronotype du soir [76, 77].
Autres effets délétères du travail posté sur la santé
Il existe très peu d’études épidémiologiques ayant trait aux relations entre travail posté et/ou travail de nuit et des localisations de cancer autres que le sein.
S’agissant du cancer de la prostate, deux études portent sur des cohortes prospectives [55, 78] auxquelles s’ajoute une étude cas témoin [79] dans laquelle il est fait état d’une augmentation modérée du risque de cancer de la prostate. S’agissant du cancer colorectal, le nombre également très faible d’études fait état d’une augmentation modérée du risque du travail posté ou de nuit [55, 56, 80, 81]. D’autres travaux sont donc nécessaires pour confirmer ou infimer ces résultats.
Trois autres types d’effets du travail posté et/ou de nuit paraissent avérés : les effets sur la grossesse, les maladies cardio-vasculaires et les troubles digestifs. Le travail posté et/ou de nuit augmente de façon modérée le risque d’avortements spontanés, d’accouchements prématurés et de retard de croissance intra-utérin [82]. Le risque sur la grossesse, qui paraît avéré, nécessite des mesures de protection de la femme enceinte dans le but de lui éviter le travail posté et/ou de nuit. Une augmentation modérée du risque de maladies cardio-vasculaires, d’hypertension artérielle, d’élévation des taux plasmatique de cholestérol et des triglycérides et de surpoids a été rapportée [83]. Un temps de sommeil court, de moins de 6 heures, est associé à une prise de poids et à l’augmentation de l’IMC [84, 85]. La consommation de tabac, une prise alimentaire anarchique et la diminution de l’exercice physique sont également des facteurs favorisant l’augmentation du risque cardio-vasculaire du travailleur posté. En ce qui concerne les troubles digestifs une association positive a été mise en évidence entre travail posté et troubles gastro-intestinaux, ulcère duodénal et gastrique, et troubles fonctionnels intestinaux [86].
D’autres effets délétères du travail posté ont été rapportés, mais les études sont relativement peu nombreuses, souvent contradictoires, et ne permettent pas d’apporter une réponse claire. Il en est ainsi de l’association diabète-travail posté : alors qu’un risque modéré (RR 1,28) de diabète de type 2 a été associé dans la population générale lorsque la durée de sommeil quotidien est inférieure à 6h, dans le cas du travailleur posté qui est en privation voire en dette de sommeil, les données de la littérature sur l’augmentation du risque de diabète sont contradictoires, ce qui indique une relation non formellement prouvée [87]. Il en est de même des relations avec les performances cognitives comme de la tendance à la dépression ou à l’anxiété [88].
Organisation du travail posté et limitations méthodologiques des études
Un certain nombre de facteurs caractérisent le travail posté ou le travail de nuit et devraient dorénavant être pris en considération dans toute étude afin d’aboutir à des conclusions fiables et définitives [32, 89, 90, 91] : la longueur du cycle de travail, la direction (sens des aiguilles d’une montre appelé sens horaire c’est à dire matin- après-midi- nuit ou antihoraire c’est à dire nuit- après midi-matin), le nombre de nuits travaillées d’affilée, le nombre total de nuits travaillées par mois et par an, le début et la fin du poste de travail, le nombre et la position des jours de repos, la régularité ou l’irrégularité des postes de travail, le système continu ou discontinu, la vitesse de rotation (rapide ou lente) et la liste n’est pas exhaustive (Tableau 1). La tendance actuelle est passée du système de rotation traditionnel lent (rotation toutes les semaines ou toutes les deux semaines) à un système de rotation plus rapide (de 1 à 3 jours). Ce nouveau type de rotation a impacté plutôt positivement le fonctionnement du système circadien et sa désynchronisation (déplacement de la phase circadienne), la privation de sommeil etc.
Les limitations méthodologiques des études épidémiologiques portant sur le lien entre travail posté ou travail de nuit et cancer sont nombreuses; on peut citer, par exemple, les études rétrospectives, l’absence de groupe témoin dans certaines études, les auto-évaluations de paramètres comme la fatigue, la somnolence et la durée ou la qualité du sommeil, etc. Des biais peuvent exister liés à la nature du travail lui-même lorsque celui-ci est susceptible d’entraîner des troubles de l’organisme par exposition aux radiations, aux produits chimiques… Par ailleurs, un problème potentiel majeur des études sur le travail posté concerne la notion de ce qui est appelé « l’effet travailleur sain » : en raison des facteurs de sélection, un travailleur posté est une personne qui est souvent en meilleure santé, au moins au début, que les travailleurs de jour. Les études qui comparent les deux groupes de travailleurs peuvent en réalité sous-estimer les effets délétères du travail posté sur la santé [89].
La définition même du travail posté et du travail de nuit pouvant être différente d’un pays à l’autre, la nécessité s’impose aux chercheurs de recenser et décrire de façon minutieuse tous les facteurs ou paramètres qui caractérisent l’organisation du travail posté dans leurs études (Tableau 1). Bien qu’un certain nombre d’effets sur la santé aient été recensés dans les diverses études, aucun seuil limite d’exposition (5,10 ou 15 ans, voire plus) au-delà duquel on peut décrire l’apparition d’effets délétères sur la santé n’a encore pu être fixé.
Peut-on améliorer l’adaptation au travail posté et au travail de nuit ?
Faciliter l’adaptation au travail posté ou au travail de nuit est un objectif soutenu des chercheurs. Les essais ont porté sur des agents susceptibles de resynchroniser l’horloge comme la lumière et la mélatonine, mais également sur certains médicaments psychotropes avec l’objectif, en fonction du poste de travail, d’améliorer le sommeil ou au contraire d’augmenter la vigilance.
Lumière : L’exposition à la lumière forte (environ 10 000 lux), dans un créneau horaire approprié, peut être utilisée pour ses propriétés de déplacement de la phase circadienne et de remise à l’heure de l’horloge, avec amélioration des performances et de la vigilance. L’exposition à la lumière forte avant une prise de poste tôt le matin ou avant un poste de nuit permet d’améliorer les performances et la vigilance. Il reste cependant à déterminer de façon précise l’intensité utile et la durée d’exposition les plus pertinentes [in 86]. En revanche, après un poste la nuit le travailleur devra éviter le plus possible toute exposition à la lumière, qu’elle soit naturelle ou domestique, afin de faciliter son sommeil. L’utilisation dans ce but de lunettes avec des verres qui filtrent la lumière bleue paraît bénéfique [92], bien que probablement difficile d’application dans la vie courante.
La sieste (30 à 50 minutes) fait partie des stratégies de lutte contre la somnolence des travailleurs lors du travail de nuit et a été associée à une diminution des accidents et à l’amélioration de la vigilance et des performances [in 90] en raison de son effet bénéfique sur la récupération. Il reste cependant à déterminer sa durée et à quel moment du travail de nuit elle doit prendre place.
La caféine a été proposée comme psychostimulant pour augmenter la vigilance des travailleurs en poste la nuit auxquels il peut être conseillé de prendre une tasse de café en début de poste pour augmenter la vigilance pendant leur travail de nuit [93].
Certains médicaments psychotropes comme les hypnotiques ( Triazolam et Temazepam) pour les troubles du sommeil ou le Modafinil pour les troubles de la somnolence diurne, ont été utilisés à l’étranger pour lutter contre les troubles liés au travail posté ou de nuit. En France, aucune de ces molécules n’a d’indications dans les troubles liés au travail posté ou de nuit.
La prise de mélatonine par les travailleurs de nuit a été proposée aux Etats Unis [93] car c’est un agent chronobiotique qui réajuste le cycle veille-sommeil [94]. L’association mélatonine-lumière n’améliore pas l’adaptation au travail posté. La mélatonine n’a pas d’indications en France dans les troubles du travail posté ou de nuit.
En pratique il faut également avoir soin d’éviter l’exposition à la lumière 30 minutes avant le coucher, prendre un poste du matin de préférence avant 07 h, éviter de faire plus de trois nuits successives de travail nocturne, et enfin éviter le travail posté ou le travail de nuit en cas de grossesse compte tenu des risques potentiels pour la grossesse.
Conclusions
En 2012 en France , 15,4% de la population active (21,5% des hommes et 9,3% des femmes) soit 3,5 millions de personnes travaillaient la nuit de façon habituelle ou occasionnelle [95].
Dans les pays industrialisés, y compris en France, environ 75 % de la population active travaillent dans des horaires atypiques c’est-à-dire en dehors des horaires classiques, schématiquement 08 h à 17 h. Le travail posté et/ou le travail de nuit, en exposant les travailleurs à la lumière artificielle la nuit et en diminuant le temps de sommeil, désorganisent la structure circadienne, le cycle du sommeil, la vie sociale, les temps de prise alimentaire ce qui entraîne une perturbation du fonctionnement de l’horloge biologique mise en évidence dans de nombreux travaux grâce à l’utilisation de marqueurs circadiens comme la mélatonine, le cortisol, et la température corporelle. Cette désynchronisation de l’horloge interne est néfaste pour la santé sur le long terme, ce que soulignent un grand nombre d’études épidémiologiques portant, en particulier, sur le risque de cancer du sein chez les femmes en travail posté ou de nuit. Il s’agit d’une véritable question de santé publique en raison du nombre important de personnes concernées.
Il est indispensable à cet égard que les chercheurs se mobilisent pour établir un protocole expérimental consensuel qui, en tenant compte de l’ensemble des facteurs à prendre en considération tels, par exemple et de façon non exhaustive, le type de rotation, le sens de la rotation, le nombre d’années travaillées, le nombre de nuits travaillé par mois etc.. (Tableau 1) permettront de valider définitivement les résultats des nombreuses études montrant une élévation du risque du cancer du sein chez la femme exposée dans le cadre de son travail à la lumière artificielle la nuit. Des contre-mesures pourront alors être recherchées et validées pour lutter contre les effets délétères des horaires atypiques, travail posté et travail de nuit en particulier, sur la santé.
Références
[1] Touitou Y, Haus E (Eds).Biological rhythms in clinical and laboratory medicine. Springer, Berlin, 2ème éd.,1994.
[2] Stratmann M, Schibler U. Properties, entrainment, and physiological functions of mammalian peripheral oscillators. J Biol Rhythm. 2006, 21, 494–506.
[3] Brown SA, Azzi A. Peripheral circadian oscillators in mammals.Handb Exp Pharmacol. 2013;217:45-66.
[4] Albrecht U. Timing to perfection : the biology of central and peripheral circadian clocks. Neuron. 2012 ;74 :246-60.
[5] Berson, D.M., Dunn, F.A., and Takao, M. Phototransduction by
retinal ganglion cells that set the circadian clock. Science 2002;295: 1070–73.
[6] Hattar S, Liao HW, Takao M, Berson DM, Yau K.W. Melanopsin-containing retinal ganglion cells: architecture, projections, and
intrinsic photosensitivity. Science 2002;295:1065–70.
[7] Grimm C, Wenzel A, Williams T, Rol P, Hafezi F, Rome C. Rhodopsin-mediated blue-light damage to the rat retina: Effect of photoreversal of bleaching. Invest Ophthalmol Vis Sci. 2001;42:497–505.
[8] Lucas RJ. Mammalian inner retinal photorereception. Current Biol. 2013, 23 :R125-R133.
[9] Touitou Y, Arendt J, Pevet P (eds). Melatonin and the Pineal Gland. From Basic Science to Clinical Application (Elsevier Science Publishers, Edit.), 1 volume, 1993.
[10] Reppert SM, Duncan MJ, Goldman BD. Photic influences on the developing mammal. In: Ciba Foundation Symposium 117. Photoperiodism, melatonin and the pineal. London: Pittman; 1985.p. 116-28.
[11] Lewy A. Clinical Implications of the melatonin Phase Response Curve. J Clin Endocrinol Metab. 2010;95:3158-60.
[12] Zeitzer JM, Fisicaro RA2, Ruby NF3, Heller HC3. Millisecond flashes of light phase delay the human circadian clock during sleep. J Biol Rhythms. 2014 ;29:370-6.
[13] Zeitzer JM, Dijk DJ, Kronauer R, Brown E, Czeisler C. Sensitivity of the
human circadian pacemaker to nocturnal light: melatonin phase resetting
and suppression. J Physiol 2000;526 Pt 3:695–702.
[14] Chang AM, Santhi N, St Hilaire M, Gronfier C, Bradstreet DS, Duffy JF, Lockley SW, Kronauer RE, Czeisler CA. Human responses to bright light of different durations. J Physiol. 2012;590 (Pt 13):3103-12.
[15] Kuse Y, Ogawa K, Tsuruma K, Shimazawa M, Hara H. Damage of photoreceptor- derived cells in culture induced by light emitting diode-derived blue light. Sci Rep. 2014;4:1-12.
[16] Chang AM, Aeschbach D, Duffy JF, Czeisler CA. Evening use of light-emitting eReaders negatively affects sleep, circadian timing, and next-morning alertness. Proc Natl Acad Sci U S A. 2015;112:1232-7.
[17] Touitou Y. Adolescent sleep misalignment: a chronic jet lag and a matter of public health. J Physiol Paris 2013; 107 : 323–326
[18] Selmaoui B, Bogdan A.Auzeby A. Lambrozo J. Touitou Y. Acute exposure to 50 Hz magnetic
field does not affect hematologic or immunologic functions in healthy young men: a circadian study.
Bioelectromagnetics 11996;7:364-72
[19] Touitou Y. Magnetic field and the melatonin hypothesis. A study of workers chronically exposed to 50-Hz magnetic fields. Amer. J. Physiol, 2003; 284: R1529-R1535.
[20] Touitou Y. Is melatonin the hormonal missing link between magnetic field effects and human diseases? Cancer Causes Control, 2006; 17:547-52.
[21] De Seze R, Ayoub J, Peray P, Miro L, Touitou Y. Evaluation in humans of the effects of radiocellular telephones on the circadian patterns of melatonin secretion, a chronobiological rhythm marker. J Pineal Res.1999;27:237-42.
[22] Arendt J. Managing jet lag : Some of the problems and possible new solutions. Sleep Med Rev., 2009, 1, 249-56.
[23] Herxheimer A.. Jet lag. BMJ Clin Evid. 2014, April 29 . pii: 2303.
[24] Ashkenazi I.E., Reinberg A.E.,Motohashi Y. Interindividual differences in the flexibility of human temporal organization : pertinence to jet lag and shiftwork. Chronobiol. Int., 1997; 14:99-113.
[25] Arendt J. Shift work : coping with the biological clock. Occup Med (Lond), 2010; 60: 10-20.
[26] Wirtz A., Nachreiner F.The effects of extended working hours on health and social well being : a comparative analysis of four independent samples. Chronobiol Int. 2010 ; 27 :1124-34.
[27] Reinberg A, Riedel M, Brousse E, Floc'h NL, Clarisse R, Mauvieux B, Touitou Y et al.Circadian
time organization of professional firemen: Desynchronization-tau differing from 24.0 hours
documented by longitudinal self-assessment of 16 variables. Chronobiol Int. 2013;30:1050-65.
[28] Reinberg A, Smolensky MH, Riedel M, Touitou Y, Floc'h NL, Clarisse R et al. Chronobiologic perspectives of black time-Accident risk is greatest at night: An opinion paper. Chronobiol Int. 2015 ; 16:1-14
[29] Touitou Y, Coste O, Dispersyn G, Pain L. Disruption of the circadian system by environmental factors : effects of hypoxia, magnetic fields and général anesthetic agents. Adv Drug Del Rev 2011 ;62 :928-45.
[30] Straif K, Baan R, Grosse Y, Secretan BE, Ghissassi FE, Bouvard V, et al. Carcinogenicity of shift-work, painting, and fire-fighting. Lancet Oncol. 2007;8:1065–6.
[31] Stevens RG, Hansen J, Costa G, Haus E, Kauppinen T, Aronson KJ et al. Considerations of circadian impact for defining‘shift work’ in cancer studies : IARC Working Group Report Occup Environ Med. 2011;68:54-162.
[32] Costa, Haus E, Stevens R. Shiftwork and cancer. Considerations on rationale, mechanisms, and epidemiology. Scand J Work Environ Health. 2010;36:163-79.
[33] Hahn RA. Profound bilateral blindness and the incidence of breast cancer. Epidemiology. 1991;2:208–10.
[34] Feychting M, Osterlund B, Ahlbom A. Reduced cancer incidence among the blind. Epidemiology. 1998;9:490–4.
[35] Pukkala E, Verkasalo PK, Ojamo M, Rudanko SL. Visual impairment and cancer: a population-based cohort study in Finland. Cancer Causes Control. 1999;10:13–20.
[36] Kliukiene J, Tynes T, Andersen A. Risk of breast cancer among Norwegian women with visual impairment. Br J Cancer. 2001;84:397–9.
[37] Flynn-Evans EE, Stevens RG, Tabandeh H, Schernhammer ES, Lockley SW. Total visual blindness is protective against breast cancer. Cancer Causes Control. 2009;20(9):1753–6.
[38] Davis S, Mirick DK, Stevens RG. Night shift work, light at night, and risk of breast cancer. J Natl Cancer Inst. 2001;93:1557-62.
[39] O'Leary ES, Schoenfeld ER, Stevens RG, Kabat GC, Henderson K, Grimson R et al. Shift work, light at night, and breast cancer on Long Island, New York. Am J Epidemiol. 2006;164:358-66.
[40] Kloog I, Haim A, Stevens RG, Barchana M, Portnov BA. Light at night co-distributes with incident breast but not lung cancer in the female population of Israel. Chronobiol. Int. 2008;25:65-81.
[41] Kloog I, Stevens RG, Haim A, Portnov BA. Nighttime light level co-distributes with breast cancer incidence worldwide. Cancer Causes Control. 2010;21:2059-2068.
[42] Kim YJ, Lee E, Lee HS, Kim M, Park MS. High prevalence of breast cancer in light polluted areas in urban and rural regions of South Korea: An ecologic study on the treatment prevalence of female cancers based on National Health Insurance data. Chronobiol Int. 2015;32:657-67.
[43] Verkasalo PK, Lillberg K, Stevens RG, Hublin C, Partinen M. Koskenvuo M et al.. Sleep duration and breast cancer : a prospective cohort study. Cancer Res. 2005;65 :9595-600
[44] Pinheiro SP, Schernhammer ES, Tworoger SS, Michels KB. A prospective study on habitual duration of sleep and incidence of breast cancer in a large cohort of women. Cancer Res. 2006 ;66 :5521-5
[45] Schernhammer ES, Laden F, Speizer FE,Willett WC, Hunter DJ, Kawachi I et al. Rotating night shifts and risk of breast cancer in women participating in the Nurses Health Study. J Natl Cancer Inst. 2001;93:1563-1568.
[46] Schernhammer ES, Kroenke CH, Laden F, Hankinson SE. Night work and risk of breast cancer. Epidemiology. 2006;17:108-11.
[47] Davis S, Mirick DK, Stevens RG. Night shiftwork, light at night, and risk of breast cancer. J Natl Cancer Inst 2001;93:1557–62.
[48] Hansen J. Increased breast cancer risk among women who work predominantly at night. Epidemiology. 2001;12:74-77.
[49] Hansen J, Stevens RG. Case-control study of shift-work and breast cancer risk in Danish nurses: impact of shift systems. Eur J Cancer 2012 ;48 :1722-9
[50] Lie JA, Andersen A, Kjaerheim K. Cancer risk among 43000 Norwegian nurses. Scand J Work Environ Health. 2007;33:66-73.
[51] Lie JA, Kjuus H, Zienolddiny S, Haugen A, Stevens RG, Kjaerheim K.et al. Night work and breast cancer risk among Norwegian nurses: assessment by different exposure metrics. Am J Epidemiol 2011;173:1272–9.
[52] Menegaux F, Truong T, Anger A, Cordina-Duverger E, Lamkarkach F, Arveux P et al. Night work and breast cancer: A population-based case–control study in France (the CECILE study). Int J Cancer. 2013;132:924–931.
[53] Pesch B, Harth V, Rabstein S, Baisch C, Schiffermann M, Pallapies D, et al. Night work and breast cancer – results from the German GENICA study. Scand J Work Environ Health. 2013 ; 39 :448-55
[54] Pronk A, Ji BT, Shu XO, Xue S, Yang G, Li HL, Rothman N, Gao YT, Zheng W, Chow WH. Night-shift work and breast cancer risk in a cohort of Chinese women. Am J Epidemiol. 2010;171 :953-9.
[55] Schwartzbaum J, Ahlbom A, Feychting M. Cohort study of cancer risk among male and female shift workers. Scand J Work Environ Health. 2007;33:336–43.
[56] Tynes T, Hannevik M, Andersen A, Vistnes AL, Haldorsen T.Incidence of breast cancer in Norwegian female radio and telegraph operators. Cancer Causes Control 1996;7:197–204.
[57] Megdal SP, Kroenke CH, Laden F, Pukkala E, Schernhammer ES. Night work and breast cancer risk: a systematic review and meta-analysis. Eur J Cancer. 2005;41:2023–32.
[58] Pukkala E, Auvinen A, Wahlberg G. Incidence of cancer among Finnish airline cabin attendants, 1967-92. BMJ. 1995;311:649–52.
[59] Reynolds P, Cone J, Layefsky M, Goldberg DE, Hurley S. Cancer incidence in California flight attendants (United States). Cancer Causes Control. 2002;13:317–24.
[60] Rafnsson V, Sulem P, Tulinius H, Hrafnkelsson J. Breast cancer risk in airline cabin attendants: a nested case-control study in Iceland. Occup Environ Med. 2003;60:807–9.
[61] Blettner M, Zeeb H, Langner I, Hammer G, Schafft T. Mortality from cancer and other causes among airline cabin attendants in Germany, 1960-1997. Am J Epidemiol. 2002;156:556–65.
[62] Zeeb H, Blettner M, Langner I, Hammer GP, Ballard TG, Santaquilani M, et al. Mortality from cancer and other causes among airline cabin attendants in Europe: a collaborative cohort study in eight countries. Am J Epidemiol. 2003;158:35–46.
[63] Kojo K, Pukkala E, Auvinen A. Breast cancer risk among Finnish cabin attendants: a nested case-control study. Occup Environ Med. 2005;62:488–93.
[64] Tokumaru O, Haruki K, Bacal K, Katagiri T, Yamamoto T, Sakurai Y. Incidence of cancer among female flight attendants: a meta-analysis. J Travel Med. 2006;13:127–32.
[65] Band PR, Le ND, Fang R, Deschamps M, Coldman AJ, Gallagher RP, et al. cohort study of Air Canada pilots: mortality, cancer incidence, and leukemia risk. Am J Epidemiol. 1996;143:137–43.
[66] Rafnsson V, Hrafnkelsson J, Tulinius H. Incidence of cancer among commercial airline pilots.
Occup Environ Med. 2000;57:175–9.
[67] Hammar N, Linnersjö A, Alfredsson L, Dammström BG, Johansson M, Eliasch H. Cancer incidence in airline and military pilots in Sweden 1961–1996. Aviat Space Environ Med. 2002;73:2–7.
[68] Pukkala E, Aspholm R, Auvinen A, Eliasch H, Gundestrup M, Haldorsen T, et al. Cancer incidence among 10,211 airline pilots: a Nordic study. Aviat Space Environ Med. 2003;74:699–706.
[69] Lewy AJ, Wehr TA, Goodwin FK, Newsome DA, Markey SP. Light suppresses melatonin secretion in humans. Science 1980;210:1267–9.
[70] Schernhammer ES, Rosner B, Willett WC, Laden F, Colditz GA, Hankinson SE. Epidemiology of urinary melatonin in women and its relation to other hormones and night work. Cancer Epidemiol Biomarkers Prev. 2004;13:936–43.
[71] Nelson HD, Humphrey LL, Nygren P, Teutsch SM, Allan JD. Posthormone replacement therapy : scientific review. JAMA. 2002; 288:872-81.
[72] Reiter RJ. Mechanisms of cancer inhibition by melatonin. J Pineal Res. 2004;37:213–4.
[73] Dimitrov S, Lange T, Tieken S, Fehm HL, Born J. Sleep associated régulation of T helper 1/T helper 2 cytokine balance in humans. Brain Behav Immun 2004;18:341-8
[74] Lange T, Dimitrov S, Born J. Effects of sleep and circadian rhythm on the human immune system. Ann NY Acad Sci 2010;1193:48-59.
[75] Haus EL, Smolensky MH. Shift work and cancer risk : potential mechanistic rôles of circadian disruption, light at night, and sleep deprivation. Sleep Med Rev. 2013 ; 17 :273-84
[76] Saksvik IB, Bjorvatn B, Hetland H, Sandal GM, Pallesen S.Individual differences in tolerance to shift work – A systematic review. Sleep Med Rev. 2011;15:221-35.
[77] Ramin C, Devore EE, Pierre-Paul J, Duffy JF, Hankinson SE, Schernhammer ES. Chronotype and breast cancer risk in a cohort of US nurses. Chronobiol Int. 2013;30:1181-6.
[78] Kubo T, Ozasa K, Mikami K, Wakai K, Fujino Y, Watanabe Y, Miki T et al., Prospective cohort study of the risk of prostate cancer among rotating-shift workers: findings from the Japan collaborative cohort study. Am J Epidemiol. 2006, 164: 549-555.
[79] Conlon M, Lightfoot N, Kreiger N. Rotating shift work and risk of prostate cancer. Epidemiology. 2007, 18:182-3.
[80] Schernhammer E, Laden F, Speizer FE, Willett WC, Hunter DJ, Kawachi I, et al., Night-shift work and risk of colorectal cancer in the nurses’ health study. J Natl Cancer Inst.. 2003; 95: 825-8.
[81] Thompson CL, Larkin EK, Patel S, Berger NA, Redline S, Li L et al., Short duration of sleep increases risk of colorectal adenoma. Cancer. 2011;15: 841-7.
[82] Quansah R, Jaakkola JJ. Occupational exposures and adverse pregnancy outcomes among nurses: a systematic review and meta-analysis J Womens Health (Larchmt). 2010;19:1851-62.
[83] Brown DL, Feskanich D, Sánchez BN, Rexrode KM, Schernhammer ES, Lisabeth LD. Rotating night shift work and the risk of ischemic stroke.Am J Epidemiol 2009;1069 :1370-7
[84] Fonken LK, Workman JL, Walton JC, Weilz M, Morris JM, Haim A, Nelson RJ. Light at night increases body mass by shifting the time of food intake. Proc Natl Acad Sci USA. 2010;107:18664-9.
[85] van Drongelen A, Boot CR, Merkus SL, Smid T, van der Beek AJ. The effects of shift work on body weight change – a systematic review of longitudinal studies. Scand J Work Environ Health. 2011; 37: 263-75.
[86] Caruso CC, Lusk SL, Gillespie BW. Relationship of work schedules to gastrointestinal diagnoses, symptoms, and medication use in auto factory workers. 586-598. Am J Ind Med. 2004;46:586-98.
[87] Knutsson, Kempe A. Shift work and diabetes – A systematic review. Chronobiol Int. 2014 ; 31:1146-51.
[88] Oyane N, Pallesen S, Moen B, Akerstedt T, Bjorvatn B . Associations Between Night Work and Anxiety, Depression, Insomnia, Sleepiness and Fatigue in a Sample of Norwegian Nurses. PLos ONE 2013 ; 8 :e70228
[89] Pallesen S, Bjorvatn B, Mageroy N, Saksvik IB, Waage S, Moen BE. Measures to counteract the negative effects of night work. Scand J Work Environ Health 2010; 36 :109-20
[90] Zee PC, Goldstein CA. Treatment of shift work and jet lag. Curr Treatment Options Neurol. 2010;12 :396-411.
[91] Société Française de Médecine du Travail. Surveillance médico-professionnelle des travailleurs postés et/ou de nuit. Rapport Mai 2012.
[92] Sasseville A, Hébert M. Using blue-green light at night and blue-blockers during the day to improves adaptation to night work: a pilot study. Prog Neuropsychopharmacol Biol Psychiatry. 2010;34:1236-42
[93] Morgenthaler TI, Lee-Chiong T, Alessi C et al. Practice parameters for the clinical evaluation and treatment of circadian rhythm sleep disorders. Sleep. 2007 ;30 :1445-58.
[94] Touitou Y, Bogdan A. Promoting adjustment of the sleep-wake cycle by chronobiotics. Physiol Behav. 2007;90:294-300.
[95] Direction de l'animation de la recherche, des études et des statistiques (DARES), Ministère du travail, de l'emploi, de la formation professionnelle et du dialogue social. Analyses, Aout 2014 n°062.
Figure 1- Représentation schématique du système circadien
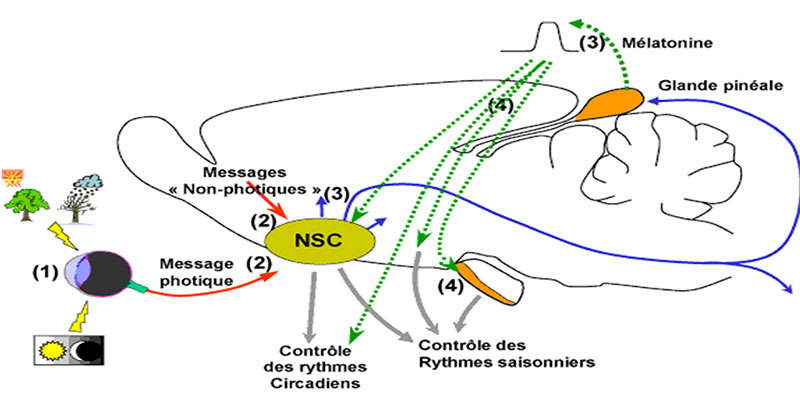
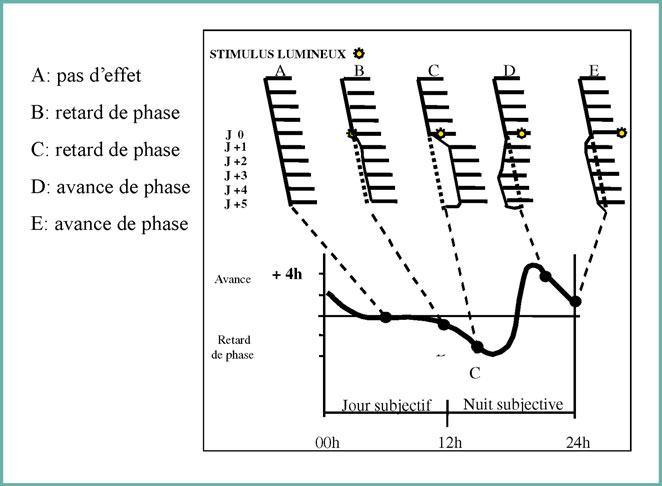
Figure 2- Exemple de courbe de réponse de phase (PRC) de l’activité motrice de rongeurs soumis un stimulus lumineux appliqué à différents stades circadiens. Selon l’heure d’exposition la réponse est très différente : pas d’effet, avance de phase ou retard de phase (d’après Moore-Edde)
Descripteur MESH : Lumière , Travail , Santé , Santé publique , Risque , Mélatonine , Sommeil , Tumeurs du sein , France , Population , Signaux , Temps , Femmes , Rotation , Grossesse , Privation de sommeil , Glande pinéale , Vie , Tumeurs de la prostate , Prostate , Rôle , Diabète , Études épidémiologiques , Études prospectives , Recherche , Rétine , Personnes , Association , Patients , Accidents , Obscurité , Métabolisme , Cancérogènes , Mammifères , Cellules , Littérature , Cellules ganglionnaires rétiniennes , Champs magnétiques , Troubles du sommeil , Déplacement , Terminaisons nerveuses , Radio , Oestrogènes , Technologie , Rein , Ulcère duodénal , Repos , Restauration , Tabac , Système immunitaire


