Vous êtes dans : Accueil > Actualités médicales >
Europe
2055 résultats triés par date
affichage des articles n° 289 à 307
Tumeurs de la vessie superficielles : l’IPC a traité son 30e patient avec la thermochimiothérapie
Caducee.net, le 07/05/2019 : Pour traiter les tumeurs de la vessie superficielles, l’Institut Paoli-Calmettes (IPC) propose à ses patients éligibles une approche thérapeutique innovante : la thermochimiothérapie. Si elle est encore peu développée en France, elle est bien plus répandue en Europe et les premiers résultats sont prometteurs. […].
FIN DE VIE : Vincent Lambert et tous les autres…
Valérie Sugg, le 21/05/2019 : Pendant près de 20 ans, Valérie Sugg a travaillé dans un service de cancérologie hospitalier en accompagnement des personnes malades, de leurs proches souvent vers la rémission, mais parfois, aussi, dans un accompagnement en fin de vie. Elle nous parle de la complexité de l’histoire familiale de Vincent Lambert, de son état végétatif et du combat médiatisé, mais aussi des autres, de beaucoup d’autres, souvent atteints de maladies incurables en phase palliative, qui ne parviennent pas à être entendus dans leur choix de fin de vie. Un sondage IFOP publié le 3 janvier 2019 confirme que 89 % des Français sont favorables à une nouvelle loi légalisant le suicide assisté et/ou l’euthanasie. Que vient illustrer la situation de Vincent Lambert de la particularité française au sein d’une Europe beaucoup plus active sur ce sujet ? […].
Thérapies cellulaires et géniques : le système de financement est inadapté pour le cabinet Asterès
ASTERES, le 22/11/2019 : Le cabinet de conseil Asterès publie ce jour deux études sur les thérapies cellulaires et géniques, réalisées avec le soutien financier de bluebird bio. Au cours des dernières années, huit thérapies cellulaires et géniques ont été autorisées en Europe et d’ici peu, près d’une quarantaine pourraient faire leur apparition sur le marché. Ces traitements innovants, qui visent à soigner des maladies génétiques graves et certains cancers, représentent une avancée médicale majeure et un espoir sans précédent pour les patients. Toutefois, leur arrivée sur le marché français pourrait nécessiter des adaptations importantes de notre système de santé. […].
Une biopsie du sein guidée par angiomammographie : une première mondiale signée Gustave Roussy
Gustave ROUSSY, le 02/12/2019 : Gustave Roussy, premier centre de lutte contre le cancer en Europe, vient de signer une première mondiale en mettant au point une nouvelle technique de biopsie guidée par angiomammographie. L’établissement de référence offre ainsi à ses patientes une alternative plus courte, plus confortable et plus accessible à la biopsie du sein guidée par IRM. […].
OASIS Group fait l'acquisition de Niche Health
OASIS Group, le 03/12/2019 : DUBLIN, 3 décembre 2019 /PRNewswire/ -- OASIS Group, l'un des plus grands fournisseurs de gestion des dossiers et de l'information (RIM) en Europe, a annoncé aujourd'hui l'acquisition de Nichesys Limited t/a Niche Health, fournisseur du logiciel et du service noteSpace pour le stockage et la numérisation des dossiers médicaux en soins primaires britanniques. […].
Appel à candidature pour le programme de bourses Tsinghua Amgen 2020
School of Pharmaceutical Sciences, Tsinghua University, le 18/01/2020 : PÉKIN, 18 janvier 2020 /PRNewswire/ -- Le programme de bourses Amgen (Amgen Scholars Program, ASP) est un programme international financé par la Fondation Amgen sous la direction de l'université Harvard qui vise à accroître les possibilités de recherche pour les étudiants qui s'engagent à poursuivre une carrière dans le domaine des sciences biomédicales. Dans le cadre du programme d'été de huit ou dix semaines, des étudiants remarquables de premier cycle provenant des quatre coins du monde peuvent entreprendre des projets de recherche sous la direction de professeurs de classe mondiale, participer à des activités de mise en réseau et à des séminaires de pointe et prendre part à un symposium à titre de représentants dans leur région respective. Jusqu'à présent, 24 établissements d'enseignement et de recherche de premier plan aux États-Unis, en Europe, en Asie, en Australie et au Canada ont accueilli le programme d'été, dont quatre établissements en Asie, à savoir l'université nationale de Singapour, l'université de Tokyo, l'université de Kyoto et l'université Tsinghua. […].
La crise des antimicrobiens : de nouveaux antibiotiques pourraient éviter 230 000 décès par an
Menarini I.F.R., le 30/01/2020 : FLORENCE, Italie, 30 janvier 2020 /PRNewswire/ -- Le lancement de nouveaux antibiotiques permettrait de réduire le nombre de décès liés aux superbactéries en les faisant passer de 50-55 % à 10-15 %. Si ces nouveaux antibiotiques étaient utilisés, un tiers des vies seraient sauvées et plus de 230 000 décès seraient évités à l'échelle mondiale par an, dont 11 000 ne serait-ce qu'en Europe. […].
Gencurix lance dans l'UE un nouveau kit de diagnostic du coronavirus
PRNEWSWIRE, le 24/03/2020 : SÉOUL, Corée du Sud, 24 mars 2020 /PRNewswire/ -- Un nouveau kit de diagnostic de la COVID-19, développé par Gencurix (KONEX 229000), bientôt disponible en Europe. […].
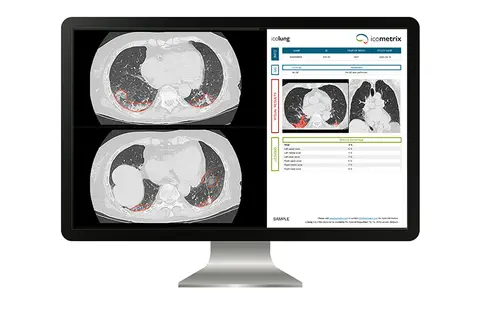
icometrix lance la première solution certifiée CE basée sur l'IA pour l'analyse de scanner thoracique dans la lutte contre le COVID-19
PRNEWSWIRE, le 23/04/2020 : LOUVAIN, Belgique, 23 avril 2020 /PRNewswire/ -- icometrix, la VUB, l'UZ Brussel, la KU Leuven, l'UZ Leuven, et l'UZ Antwerpen, ensemble avec bien d'autres hôpitaux et organisations, joignent leurs forces dans une initiative globale qui tire parti de l'intelligence artificielle (IA) dans la lutte contre le COVID-19. Cette collaboration multinationale a abouti au développement d'un algorithme basé sur l'IA, icolung, qui a reçu la certification CE pour l'usage clinique en Europe. icolung est la première solution basée sur l'IA résultant d'une collaboration contre le COVID-19 et offre une quantification rapide et objective de la pathologie pulmonaire à partir des scanners thoraciques chez les patients admis pour le COVID-19. […].
Une technologie irlandaise déployée en Afrique du Sud dans le cadre de la réouverture d'événements musicaux internationaux
PRNEWSWIRE, le 23/12/2020 : DUBLIN, 23 décembre 2020 /PRNewswire/ --Health Passport Europe, établi en Irlande, s'est associé à Big Concerts et à The Entertainment Group pour rouvrir en toute sécurité l'industrie de l'événementiel en Afrique du Sud, en s'appuyant sur les derniers développements en matière de dépistage rapide de la COVID-19 et de la technologie mobile fiable de Health Passport Europe. […].
Myélome Multiple : Sanofi lance Sarclisa® (isatuximab)
Caducee.net, le 05/02/2023 : Sanofi a annoncé le lancement de Sarclisa® en France le 2 février 2023. Sarclisa® est un anticorps monoclonal approuvé en Europe en tant que premier et unique anti-CD38. Il peut être administré en association avec pomalidomide et dexaméthasone (Pd) ou carfilzomib et dexaméthasone (Kd). Ce médicament produit en France est destiné aux patients atteints de myélome multiple en rechute et/ou réfractaire. […].
Dépistage du cancer du sein, Syantra obtient le marquage CE pour un test sanguin innovant
Caducee.net, le 19/04/2023 : Syantra a annoncé le 18 avril l'obtention du marquage CE pour son test sanguin Syantra DXTM Breast Cancer, développé sur la plateforme de biopsie liquide Syantra DX, ouvrant ainsi la voie à sa commercialisation en Europe. […].
EirGenix achève l'essai clinique de phase 1 de son deuxième biosimilaire EG1206A contre le cancer du sein
PRNEWSWIRE, le 03/05/2023 : TAIPEI, 4 mai 2023 /PRNewswire/ -- EirGenix, Inc. (6589.TT) a annoncé le 28 avril avoir terminé en Europe l'essai clinique de phase 1 (EGC101) de son deuxième biosimilaire contre le cancer du sein EG1206A. En comparant EG1206A à Perjeta® de Roche aux États-Unis et dans l'Union européenne, les résultats de l'analyse des données cliniques montrent que les principaux indicateurs d'essai ont satisfait à la norme de bioéquivalence pharmacocinétique. EG1206A est un médicament biosimilaire de l'anticorps HER2 de deuxième génération Perjeta® (pertuzumab). EG1206A a un mécanisme unique de liaison pour les récepteurs HER2 qui peut produire un double effet de blocage. En association avec le trastuzumab, un anticorps HER2 de première génération, le pertuzumab a un effet synergique dans le traitement du cancer du sein au stade précoce HER2-positif et du cancer du sein métastatique. […].
Scanners pédiatriques et cancers hématologiques sont liés
Caducee.net, le 09/01/2024 : Chaque année, plus d'un million d'enfants en Europe passent des scanners CT, une pratique qui soulève des questions sur les risques de cancer. […].
Le cancer bronchique
Ludovic Baene, Professeur Jacques Robert, le 15/04/2002 : Le cancer bronchique est une tumeur maligne originaire de la muqueuse tapissant les bronches. On parle de cancer primitif du poumon ou plus communément du cancer du poumon.Histologie L'Organisation Mondiale de la Santé (OMS) distingue les cancers bronchiques à petites cellules (CBPC) et les cancers bronchiques à non petites cellules (CBNPC) c'est à dire : carcinomes épidermoïdes, adénocarcinomes, carcinomes à grandes cellules. - Les cancers à petites cellules sont des tumeurs neuroendocrines qui fixent la Neuron Specific Enolase (NSE) : ils représentent 20% des cancers bronchiques. - Les cancers épidermoïdes sont les plus fréquents en Europe : 55% des cancers bronchiques. - Les adénocarcinomes sont les cancers glandulaires (plus fréquents aux Etats Unis) : 20% des cancers bronchiques. - Les carcinomes à grandes cellules de moins en moins diagnostiqués : 5% des cancers bronchiques. […].
Une initiative européenne pour renforcer le secteur infirmier
Caducee.net, le 03/09/2024 : La Commission européenne a récemment conclu un partenariat avec le Bureau régional de l'Organisation mondiale de la santé (OMS) pour l'Europe, visant à renforcer le secteur infirmier dans les États membres. Cet accord, soutenu par un financement de 1,3 million d'euros via le programme EU4Health, s'étendra sur trois ans et portera une attention particulière aux pays souffrant de pénuries critiques de personnel infirmier. L'objectif principal est d'améliorer l'attractivité de la profession et de retenir les infirmières dans les systèmes de santé, assurant ainsi une meilleure qualité des soins à travers l'Union européenne. […].
Sténose aortique en France : Une décennie d’évolution épidémiologique et ses défis
Caducee.net, le 21/01/2025 : La sténose aortique (SA) est la maladie valvulaire la plus fréquente en Europe et un défi croissant pour les systèmes de santé. Une étude majeure intitulée "Epidemiological Features of Aortic Stenosis in a French Nationwide Study: 10-Year Trends and New Challenges", publiée dans le Journal of the American Heart Association (2020), offre une analyse exhaustive des tendances épidémiologiques, des avancées thérapeutiques et des disparités sociales liées à cette pathologie entre 2006 et 2016. […].
CONSOMMATIONS DE SUBSTANCES PSYCHOACTIVES DES éLèVES DE 16 ANS DANS 35 PAYS EUROPEENS
INSERM, le 12/12/2004 : Les résultats 2003 de la troisième enquête ESPAD menée auprès de plus de 100 000 élèves européens permettent de connaître leurs usages de produits licites et illicites. Le tabagisme est stable ou diminue dans une majorité de pays. […].