Vous êtes dans : Accueil > Actualités médicales >
Pancréas
191 résultats triés par date
affichage des articles n° 127 à 145
Microbiome et diabète: Malade ou sain ? Le métabolisme bactérien nous apporte la réponse et l'explication
University of Luxembourg, le 12/10/2016 : ESCH-SUR-ALZETTE, Luxembourg, October 11, 2016 /PRNewswire/ --L'intestin est un système complexe : d'innombrables bactéries le colonisent et il nous aide à digérer la nourriture. Des scientifiques du Luxembourg Centre for Systems Biomedicine (LCSB) de l'Université du Luxembourg, en collaboration avec l'IBBL (Integrated Biobank of Luxembourg), le Centre Hospitalier de Luxembourg et le Centre Hospitalier Emile Mayrisch, ont mis au point une méthode pour étudier cet écosystème - le microbiome intestinal - à un niveau de détail inédit. Cette nouvelle approche permet d'examiner le potentiel génétique des bactéries en décodant leur ADN et en évaluant leur activité par séquençage de l'ARN, les premières molécules qui apparaissent lors de la transcription de l'ADN. […].
Diabète de type 1 : le GABA offre un espoir de traitement simple, bon marché et efficace.
Caducee.net, le 09/12/2016 : Des chercheurs de l' Institut de biologie Valrose (Inserm/CNRS/Université de Nice Sophia Antipolis) ont démontré dans la revue Cell que l'acide γ-aminobutyrique, (GABA), un neurotransmetteur produit naturellement mais aussi industriellement sous forme de complément alimentaire pouvait provoquer la régénération des cellules β pancréatiques dont la fonction est de sécréter de l'insuline afin de réguler la glycémie. En validant partiellement cette découverte chez l'homme, c'est un nouvel espoir de traitement qui est offert aux millions de patients souffrant du diabète de type 1. […].
Ipsen annonce l’approbation par la MHRA1 d’une nouvelle indication de Décapeptyl® dans le traitement du cancer du sein à un stade précoce chez des femmes non ménopausées
Ipsen, le 13/03/2017 : Ipsen (Euronext: IPN; ADR: IPSEY) a annoncé aujourd’hui que la MHRA (Medicines and Healthcare products Regulatory Agency) au Royaume-Uni, en coordination avec quatorze autres agences réglementaires européennes, a approuvé une nouvelle indication pour Décapeptyl® en tant que traitement adjuvant, en association avec le tamoxifène ou un inhibiteur de l'aromatase, du cancer du sein hormonosensible à un stade précoce chez des femmes à haut risque de récidive non ménopausées à l’issue d’une chimiothérapie. […].
Ipsen et Exelixis présentent les résultats de l'étude de phase 2 CABOSUN comparant le cabozantinib au sunitinib chez des patients atteints d’un carcinome avancé du rein non précédemment traités à l'ESMO 2017
Ipsen, le 09/09/2017 : Ipsen (Euronext : IPN ; ADR : IPSEY) et Exelixis, Inc. (NASDAQ : EXEL) ont annoncé aujourd'hui les résultats actualisés de l'étude randomisée de phase 2 CABOSUN évaluant le cabozantinib chez des patients atteints d’un carcinome avancé du rein (RCC) non précédemment traité, à risque intermédiaire ou élevé selon l'IMDC (International Metastatic Renal Cell Carcinoma Database Consortium). L'investigateur principal, Toni K. Choueiri, M.D., présentera aujourd'hui les données détaillées du late-breaking abstract sur CABOSUN [#LBA38_PD] lors de la séance de présentation de poster Tumeurs génito-urinaires, non prostatiques, à partir de 14h45 CEST (heure locale de Madrid) / 8h45 EDT / 5h45 PDT, dans le cadre du congrès annuel de l'European Society for Medical Oncology (ESMO) 2017, qui se déroule du 8 au 12 septembre 2017 à Madrid en Espagne. […].
Ipsen reçoit la validation de l'Agence européenne du médicament pour la demande de nouvelle indication de Cabometyx® (cabozantinib) en traitement de première ligne pour les patients adultes atteints de carcinome avancé du rein
Ipsen, le 08/09/2017 : Ipsen (Euronext: IPN; ADR: IPSEY) a annoncé aujourd'hui que l'Agence européenne du médicament (EMA), l'autorité de santé européenne, a validé ce jour la demande de l’ajout d’une nouvelle indication dans le traitement en première ligne du carcinome avancé du rein (aRCC) pour Cabometyx® (cabozantinib). […].
Cancer du rein avancé : CABOMETYX® (cabozantinib) bientôt disponible
Caducee.net, le 30/01/2018 : La filiale française d’Ipsen (Euronext: IPN; ADR: IPSEY) annonce la publication prochaine au Journal Officiel pour CABOMETYX® (cabozantinib) dans le cadre de son Autorisation de Mise sur le Marché (AMM) de son inscription sur la liste des spécialités remboursables aux assurés sociaux ainsi que sur la liste des spécialités agréées à l’usage des collectivités. […].
Ipsen annonce la présentation de nouvelles données cliniques lors de l'ISPRM 2018 démontrant son engagement dans la recherche sur les neurotoxines
Ipsen, le 04/07/2018 : Ipsen (Euronext: IPN ; ADR : IPSEY) a annoncé aujourd'hui que son portefeuille en neurotoxines ferait l'objet de 13 abstracts lors du 12ème Congrès mondial de l'International Society of Physical and Rehabilitation Medicine (ISPRM), qui se tiendra du 8 au 12 juillet à Paris. […].
Ipsen et BioLabs annoncent l’ouverture d’un nouveau centre d'innovation à Cambridge (Etats-Unis) pour favoriser le développement de nouveaux traitements pour les patients
Ipsen, le 19/07/2018 : Ipsen, groupe biopharmaceutique mondial focalisé sur l’innovation et la médecine de spécialité, a annoncé aujourd’hui un partenariat avec BioLabs pour l’ouverture d’un espace de travail partagé dédié aux sciences de la vie, au sein de son nouveau hub mondial situé en Amérique du Nord, à Kendall Square, Cambridge (Massachusetts). L’ « Ipsen Innovation Center - BioLabs » (IPSEN-ICB) est un nouvel espace collaboratif de 1 400 m2 (15 000 pi2), disposant de bureaux et de laboratoires entièrement équipés, qui a pour but de soutenir des entrepreneurs et des startups qui développent la prochaine génération de traitements pour les patients. […].
TNEp : Pfizer publie une étude de phase 4 sur Sutent
PFIZER, le 07/12/2018 : Une étude de phase IV nouvellement publiée dans la revue Neuro-endocrinology[i] apporte des données complémentaires sur Sutent dans le traitement des tumeurs neuro-endocrines pancréatiques (TNEp) bien différenciées. […].
4D pharma et MD Anderson Cancer Center vont évaluer les produits biothérapeutiques vivants pour les tumeurs solides
4D Pharma PLC, le 07/01/2019 : LEEDS, Angleterre et HOUSTON, January 7, 2019 /PRNewswire/ --4D pharma plc (AIM : DDDD) et l'université du centre médical contre le cancer MD Anderson du Texas (University of Texas MD Anderson Cancer Center) ont annoncé aujourd'hui une collaboration stratégique visant à évaluer le portefeuille de produits oncologiques biothérapeutiques vivants de 4D dans le cadre d'une large gamme de cancers. […].
Ipsen présente les résultats de la première étude sur l'homme d'une neurotoxine recombinante à action rapide (rBoNT-E) au Congrès TOXINS 2019
Ipsen, le 17/01/2019 : Les résultats de la première étude chez l'homme d'une neurotoxine recombinante seront présentés lors de la conférence internationale TOXINS 2019 qui se tiendra à Copenhague (Danemark). La neurotoxine botulique recombinante de sérotype E (rBoNT-E) d'Ipsen a été étudiée dans le cadre d'une étude de phase I qui a caractérisé son profil de sécurité et de tolérance chez des volontaires sains1. L'étude a également démontré qu'elle agissait plus rapidement et moins longtemps que les neurotoxines botuliques de type A existantes, et que son pic d'action était atteint plus rapidement. D'autres études seront menées pour établir les utilisations esthétiques et thérapeutiques potentielles de ce traitement expérimental. […].
Ipsen s'offre Clementia Pharmaceuticals et renforce son portefeuille dans les Maladies Rares
Ipsen, le 25/02/2019 : Ipsen (Euronext : IPN ; ADR : IPSEY) et Clementia Pharmaceuticals (NASDAQ : CMTA) ont annoncé aujourd’hui avoir conclu un accord en vertu duquel Ipsen se porte acquéreur de la totalité des actions de Clementia Pharmaceuticals, dont la molécule en phase avancée, le palovarotène, un agoniste sélectif du récepteur gamma de l’acide rétinoïque (RARγ), pour le traitement des personnes atteintes de fibrodysplasie ossifiante progressive (FOP), d’ostéochondromes multiples (OM) et d’autres maladies. L’acquisition procédera selon un plan d’arrangement approuvé par la Cour en vertu de la Loi canadienne sur les sociétés par actions. […].
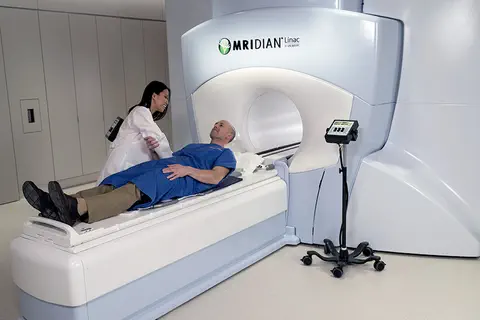
L'Institut Paoli-Calmettes utilise l'IRM pour cibler les radiothérapies grâce à un équipement unique en France
IPC, le 26/02/2019 : Les premiers patients ont été traités avec l'IMR-Linac de ViewRay, le MRIdian®, à l'Institut Paoli-Calmettes cette semaine : une première en France. Cet équipement de radiothérapie révolutionne la prise en charge par radiothérapie en utilisant l’imagerie par résonance magnétique (IRM) pour des irradiations plus ciblées, plus efficaces sur les tumeurs, et moins délétères pour les organes sains voisins. […].
IO Biotech présente des données sur un vaccin immunomodulateur dérivé de la CCL22
IO Biotech, le 02/04/2019 : COPENHAGUE, Danemark, 2 avril 2019 /PRNewswire/ -- IO Biotech, une société biopharmaceutique de stade clinique développant des thérapies anticancéreuses immunomodulatrices innovantes, basées sur sa technologie propriétaire T-win®, a présenté des données précliniques sur le potentiel thérapeutique d'un vaccin immunomodulateur dérivé de la CCL22. Ces données ont été présentées aujourd'hui lors de l'Assemblée annuelle 2019 de l'American Association for Cancer Research à Atlanta, en Géorgie. […].
Ipsen finalise l’acquisition de Clementia Pharmaceuticals
Ipsen, le 18/04/2019 : Ipsen (Euronext : IPN ; ADR : IPSEY) et Clementia Pharmaceuticals (NASDAQ : CMTA) ont annoncé aujourd’hui la finalisation de l’acquisition par Ipsen de Clementia Pharmaceuticals à la suite de l’approbation de l’accord par les actionnaires de Clementia et la Cour supérieure du Québec. Conformément aux termes de l’arrangement, les actionnaires de Clementia vont recevoir un paiement initial de 25 dollars américains par action et un Certificat de Valeur Garantie (CVG) par action, qui leur assure un paiement différé à hauteur de 6,00 dollars américains par CVG, sous réserve du dépôt réglementaire du palovarotène auprès de la Food and Drug Administration (FDA) aux Etats-Unis pour le traitement des ostéochondromes multiples (OM). […].
VALBIOTIS sélectionnée par les sessions scientifiques de l’American Diabetes Association, pour présenter de nouvelles données sur TOTUM-63 pour la prévention des maladies métaboliques
VALBIOTIS, le 07/06/2019 : VALBIOTIS (Paris:ALVAL) (FR0013254851 – ALVAL / éligible PEA/PME), entreprise française de Recherche & Développement engagée dans l’innovation scientifique, pour la prévention et la lutte contre les maladies métaboliques, annonce de nouveaux résultats précliniques pour TOTUM-63 obtenus de manière indépendante par l’Université de Leiden (Pays-Bas). Dans un modèle murin caractéristique du prédiabète, TOTUM-63 réduit l’inflammation dans le tissu adipeux viscéral, l’un des mécanismes pathologiques à l’origine des maladies métaboliques, notamment du diabète de type 2. Par ailleurs, l’étude a également confirmé l’efficacité de TOTUM-63 sur le métabolisme des glucides et des lipides dans ce modèle préclinique. Déjà sélectionnée en 2016 et 2017, VALBIOTIS participera pour la 3ème fois aux sessions scientifiques de l’American Diabetes Association, qui se tiendront du 7 au 11 juin à San Francisco. […].
OBI Pharma annonce le lancement d'une étude de phase 1/2 sur l' OBI-999, un conjugué anticorps-médicament (ADC) pour le traitement ciblé du cancer
OBI Pharma, Inc., le 18/12/2019 : Les patients ont commencé le traitement dans le cadre de la première étude de phase 1/2 chez l'être humain de l'OBI-999-001 à l'Université du Texas, au MD Anderson Cancer Center, à Houston (Texas), avec le Dr Apostolia M. Tsimberidou comme chercheuse principale. Il a été diagnostiqué chez ces patients des types de tumeurs par protocole, dont des cancers pancréatique et colorectal, pour lesquels les besoins médicaux non satisfaits sont élevés. Le traitement par l'OBI-999 se poursuit sans susciter d'inquiétude ou de constat observable en matière de sécurité à ce jour. […].
Diabète : la FFRD finance 4 nouveaux projets de recherche
FFRD, le 21/01/2020 : Pour sa 7e année d’engagement pour favoriser des projets de recherche, la FFRD allouera aux nouveaux lauréats non pas 3, mais 4 allocations d’un montant total de 900 000 euros. Chaque année, les projets primés, en recherche expérimentale, clinique ou translationnelle, sont prometteurs d’une meilleure prise en charge des patients. […].