Vous êtes dans : Accueil > Actualités médicales >
Pharyngite
37 résultats triés par date
affichage des articles n° 1 à 19
La dexaméthasone employée dans la pharyngite aiguë
Caducee.net, le 03/01/2002 : Selon une équipe de chercheurs américains (Mayo Clinic, Rochester, Minnesota, EU), une dose unique de 10 mg de dexaméthasone apparaît être efficace et d’une innocuité totale pour traiter la douleur de gorge dans la pharyngite aiguë. Cette étude prospective, réalisée en double aveugle et avec placebo, est publiée dans la revue Laryngoscope. […].
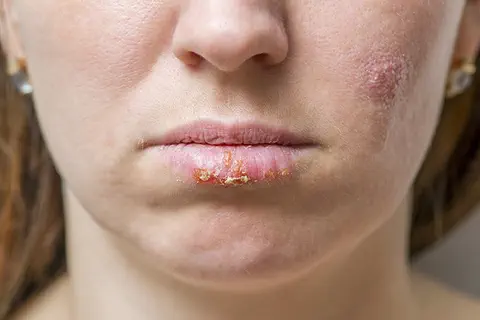
Herpès labial - Bouton de fièvre
Caducee.net, le 01/08/2024 : L'herpès labial, causé par le virus HSV-1, est une infection virale fréquente se manifestant par des vésicules douloureuses sur les lèvres. Découvrez ses causes, symptômes et modes de prévention. […].
Herpès labial - Bouton de fièvre
Caducee.net, le 01/08/2024 : L'herpès labial, causé par le virus HSV-1, est une infection virale fréquente se manifestant par des vésicules douloureuses sur les lèvres. Découvrez ses causes, symptômes et modes de prévention. […].
Puberté précoce centrale : la triptoréline mise sur le marché aux Etats-Unis
Debiopharm International SA, le 03/10/2017 : ATLANTA, Géorgie et LAUSANNE, Suisse, October 3, 2017 /PRNewswire/ --Arbor Pharmaceuticals, LLC, laboratoire pharmaceutique spécialisé basé aux Etats-Unis, et Debiopharm International SA, société de Debiopharm Group™, groupe international de sociétés biopharmaceutiques basé en Suisse, ont annoncé aujourd'hui que Triptodur™ (triptoréline) est dès à présent commercialisé aux Etats-Unis pour le traitement des patients pédiatriques âgés de deux ans et plus diagnostiqués avec une puberté précoce centrale (PPC), maladie rare touchant un sur 5000 à 10 000 enfants.1 […].
La grippe
E.Faure, le 11/01/2017 : La grippe est une maladie infectieuse et contagieuse, due aux Myxovirus influenzae A, B et C, évoluant sous la forme de grandes pandémies entrecoupées de petites épidémies saisonnières localisées et dont la gravité varie en fonction de l'épidémiologie. […].
La FDA américaine approuve l’ONTRUZANT® (trastuzumab-dttb), le premier médicament contre le cancer, de Samsung Bioepis aux États-Unis
Samsung Bioepis Co., Ltd., le 21/01/2019 : L’ONTRUZANT® est le premier biosimilaire oncologique de Samsung Bioepis à obtenir l’approbation de la FDA, et il sera commercialisé et distribué aux États-Unis (É-U) par Merck, une société connue sous le nom de MSD en dehors des États-Unis et du Canada. […].
La Commission européenne approuve l'utilisation élargie de STELARA® (ustekinumab) de Janssen pour le traitement des enfants atteints de psoriasis en plaques modéré à sévère
Janssen, le 27/01/2020 : Dans un tiers des 14 millions de cas recensés en Europe, le psoriasis commence dès l'enfance.2,3 Le psoriasis est une maladie inflammatoire à médiation immunitaire qui affecte la peau et qui se traduit par des zones de peau rouge ou enflammée couvertes de squames argentées, appelées plaques.2 Cette pathologie peut avoir un impact profond et à long terme sur la santé psychologique et la qualité de vie globale des enfants.3,4 Le développement du psoriasis pédiatrique est également associé à une forte incidence d'une faible estime de soi, et il peut avoir des ramifications à long terme jusqu’à l'âge adulte et au-delà.5 […].
Précisions sur les aspects cliniques et biologiques de la fièvre hémorragique avec syndrome rénal dans les Ardennes en 1997-99
Caducee.net, le 11/07/2000 : Au total, 48 observations de la fièvre hémorragique avec syndrome rénal (FHSR) ont été coligées dans le département des Ardennes de janvier 1997 à décembre 1999 dont 40 sur l’année 1999, rapportent dans la revue Médecine et Maladies Infectieuses des médecins de l’hôpital Corvisart de Charleville-Mézières et des chercheurs du Centre National de Référence pour les fièvres hémorragiques de l’Institut Pasteur de Paris. […].
Abbott présente des données à long terme tirées d'une étude de prolongation et montrant que le traitement par HUMIRA(R) (Adalimumab) des patients souffrant de la maladie de Crohn permet le maintien de la rémission
PR Newswire, le 21/05/2008 : ABBOTT PARK, Illinois, May 21 /PRNewswire/ -- Selon des données présentées aujourd'hui dans le cadre de la Digestive Disease Week(R), à Dan Diego, les résultats d'une étude de prolongation ouverte de deux études clés d'Abbott, soit CHARM et GAIN, montrent que les patients adultes atteints de la forme modérée à grave de la maladie de Crohn et traités par HUMIRA (adalimubab) dans le cadre de l'étude CHARM ont atteint l'état de rémission clinique à long terme, tandis que ceux traités dans le cadre de l'étude GAIN ont obtenu une réponse clinique. La DDW (Digestive Diseases Week) est le plus grand rassemblement international de médecins, de chercheurs et d'universitaires dans les domaines de la gastro-entérologie, de l'hépatologie, de l'endoscopie et de la chirurgie gastro-intestinale. Dans le cadre des études CHARM et GAIN, les patients ont été suivis tout au long d'un essai de prolongation ouvert (OLE) non contrôlé par placebo. Au total, les patients de CHARM ont été suivis pendant deux ans, et les patients de GAIN, une étude de quatre semaines, ont été suivis pendant un an. […].
La société américaine de médecine interne édite de nouvelles recommandations pour les infections des voies aériennes supérieures
Caducee.net, le 20/03/2001 : L'ACP-ASM (American College of Physicians-American Society of Internal Medicine) a présenté aujourd'hui de nouvelles recommandations pour le traitement des infections des voies respiratoires. Elles mettent particulièrement l'accent sur l'utilité très limitée des antibiotiques dans la plupart des cas d'infections chez l'adulte sain. […].