Vous êtes dans : Accueil > Actualités médicales >
Paris
1140 résultats triés par date
affichage des articles n° 667 à 685
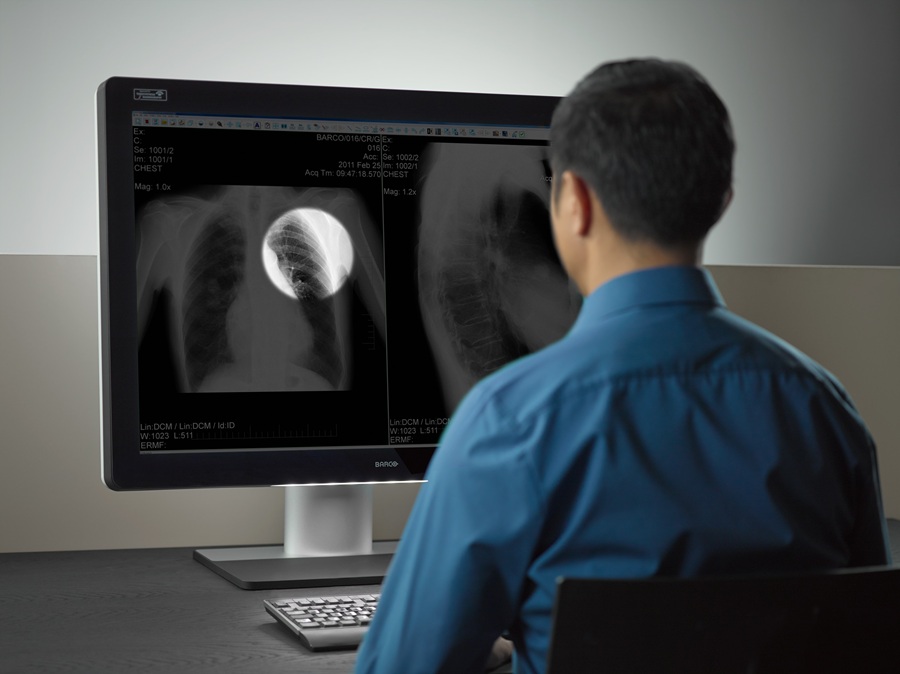
Radiologie : Barco redéfinit la salle de lecture grâce à un écran de diagnostic révolutionnaire
BARCO, le 20/10/2014 : Aujourd’hui, l’expert en imagerie médicale Barco a annoncé le lancement de Coronis Uniti™, le premier affichage de diagnostic conçu expressément pour l’imagerie PACS (Picture Archiving and Communication Systems) et la mammographie. Avec une qualité d’image inégalée, des fonctionnalités de productivité innovantes et une conception ergonomique, Coronis Uniti™ est la toute dernière réponse de Barco aux défis spécifiques que pose la radiologie moderne : augmentation des volumes d’images, complexité croissante et stress ergonomique. […].
L’accès à l’imagerie au cours des urgences : analyse de l'enquête nationale
Pr Pateron & Gauvrit, le 22/10/2014 : Pour les patients reçus aux urgences l’imagerie médicale occupe une place déterminante et structure bien souvent le parcours de soins de ces patients. En complément des enquêtes régulières menées notamment sur l’accès à l’IRM dans notre pays, la Société Française de Radiologie et la Société Française de Médecine d’Urgence ont souhaité objectiver les conditions d’accès aux examens d’imagerie pour ces patients reçus aux urgences, grâce à une enquête nationale menée cet été auprès de médecins responsables de services des deux spécialités, France entière. […].
Genclis SAS confirme le potentiel de son test diagnostique inédit Severidia® sur 47 patientes atteintes de cancer du sein triple-négatif
Genclis SAS, le 25/11/2014 : Nancy, France, le 25 novembre 2014 - Dans le cadre de la 4 ème Munich Biomarker Conference qui se tient à Munich les 25 et 26 novembre 2014, Genclis, société de diagnostic moléculaire dans les domaines de l'allergie et du cancer, présentera oralement des données supplémentaires de validation de l'utilité clinique du test Severidia ®, un biomarqueur tumoral pronostique, dans le cancer du sein triple-négatif. […].
Hyperactivité vésicale chez l’homme
Pr François Haab, le 03/12/2014 : L’Hyperactivité vésicale est un trouble caractérisé par la survenue d’une envie soudaine et irrépressible d’uriner appelée urgenturie. La sensation peut être inconfortable, et l’urgence mictionnelle peut être accompagnée ou non d’une fuite d’urine. Il s’y associe fréquemment une augmentation de la fréquence des mictions le jour et la nuit. […].
Actualités au GRCI 2014 : Le stent coronarien de CeloNova BioSciences, COBRA PzF™, obtient un faible taux de TLR de 3 % avec une courte durée de bi-thérapie anti-plaquettaire (DAPT)
CeloNova BioSciences, Inc., le 12/12/2014 : L’étude prospective, mono-centrique portait sur 100 patients, dont un grand nombre présentaient une maladie pluritronculaire, des lésions complexes et des comorbidités telles que le diabète, l’hypertension, la dyslipidémie, la fibrillation auriculaire, des antécédents de PCI, un infarctus du myocarde antérieur, entre autres. Au suivi à six mois, les résultats indiquaient zéro pour cent (0 %) de thrombose de stent, zéro pour cent (0 %) d’infarctus du myocarde, une seule mort cardiaque due à une insuffisance cardiaque terminale (1 %) et trois pour cent (3 %) de Target Lesion Revascularization (revascularisation de lésion cible ou TLR), entraînant quatre pour cent (4 %) de Major Adverse Coronary Event (évènement indésirable coronarien majeur ou MACE). […].
Somatuline® Depot® d’Ipsen est le premier traitement autorisé par la FDA aux Etats-Unis pour le traitement des patients avec des tumeurs neuroendocrines gastro-entéro-pancréatiques à un stade localement...
Ipsen, le 16/12/2014 : Somatuline® Depot® d’Ipsen est le premier traitement autorisé par la FDA aux Etats-Unis pour le traitement des patients avec des tumeurs neuroendocrines gastro-entéro-pancréatiques à un stade localement avancé ou métastatique […].
Genclis sélectionnée pour présenter son test de prédiction Severidia® à la conférence internationale St. Gallen sur le cancer du sein
Genclis SAS, le 09/01/2015 : Nancy, France, le 9 janvier 2015 - Genclis, société de diagnostic moléculaire dans les domaines de l'allergie et du cancer, annonce aujourd'hui avoir été sélectionnée pour présenter un poster sur l'utilisation des nouvelles technologies de séquençage pour prédire le devenir clinique des patientes atteintes de cancer du sein triple-négatif lors de la 14 ème conférence internationale de St. Gallen sur le cancer du sein (St. Gallen International Breast Cancer Conference), qui se tiendra à Vienne, en Autriche, du 18 au 21 mars 2015. […].
INNATE PHARMA : Ouverture du premier essai de Phase II avec IPH2201
INNATE PHARMA, le 19/12/2014 : Démarrage du premier essai de Phase II avec IPH2201, un nouvel anticorps immunomodulateur dans le domaine de l'immuno-oncologie, dans une indication de cancer de la tête et du cou […].
Sanofi : Sanofi et MannKind annoncent la mise à disposition d'Afrezza®, la seule insuline à inhaler, aux États-Unis
Sanofi, le 03/02/2015 : Paris et Valencia (Californie) - Le 3 février 2015 - Sanofi et MannKind Corporation annoncent aujourd'hui qu'Afrezza ® (insuline humaine), poudre à inhaler, la seule insuline à inhaler, est désormais disponible sur ordonnance dans les officines de l'ensemble du territoire des États-Unis. Afrezza est approuvé par la Food and Drug Administration des États-Unis pour le contrôle de l'hyperglycémie des adultes atteints de diabète de type1 et de type2. […].
Le biosimilaire du Remicade® d’Epirus reçoit l’approbation finale en Inde
EPIRUS Biopharmaceuticals, Inc., le 15/09/2014 : « Avec ces approbations finales, nous sommes désormais en mesure de fournir un produit de haute qualité aux patients ne pouvant pas s’offrir les options de traitement actuelles », a déclaré Amit Munshi, Président et chef de la direction d’Epirus. « Nous envisageons également de mettre à profit ces données cliniques pour appuyer les autres demandes d’homologation dans les marchés cibles mondiaux. » […].
L' USMCS milite pour la création de centaines de centres de santé publics
Caducee.net, le 19/02/2015 : Pour l' Union Syndicale des Médecins de Centres de Santé, Le centre de santé est un modèle d’organisation des soins ambulatoires plus que jamais d’avenir. Il a une place de choix à tenir dans un système de santé refondé, basé sur une organisation territoriale de l’offre de santé articulant efficacement secteur ambulatoire et hôpital. Il constitue la structure la plus pertinente d’accueil et d’accompagnement des usagers dans leur parcours de santé et dans un cadre de service public garanti par la loi, au service de tous les publics : accès aux droits, prévention, soins et accompagnement social. […].
Quelles attentes peut-on avoir aujourd’hui de la pharmacothérapie des troubles liés à l’usage d’alcool ?
Jean Adès, le 24/02/2015 : Au cours des dernières années, de nombreuses molécules ont été proposées dans le traitement des troubles liés à l’usage d’alcool. A côté de médicaments déjà classiques, tel l’acamprosate ou la naltrexone, de nouvelles molécules (nalméfène, GHB, baclofène) sont proposées, soit comme traitement de substitution de l’alcool, indiquées quand une abstinence totale est proposée au patient, soit comme réducteur du « craving » facilitant le retour à une consommation contrôlée ou le maintien d’une abstinence déjà obtenue. Certains de ces produits, déjà largement utilisés à l’étranger, attendent d’être commercialisés en France (nalmefene, GHB) ou, comme le baclofène peuvent désormais être prescrits sous couvert d’une Recommandation Temporaire d’Utilisation. Malgré l’engouement très médiatisé pour le baclofène, dont les effets en fonction des doses seront précisés par les résultats de deux études contrôlées en cours, les médicaments ne sont qu’un des éléments de la prise en charge du trouble complexe bio-psycho-social qu’est l’alcoolo-dépendance. Diverses formes de psychothérapies demeurent indispensables dont les médicaments proposés peuvent être un appoint utile. […].
La FDA approuve Toujeo®, l'insuline basale de Sanofi en une prise par jour
Sanofi, le 26/02/2015 : Paris, France - Le 26 février 2015 - Sanofi annonce aujourd'hui que la Food and Drug Administration (FDA) des États-Unis a approuvé Toujeo ® (insuline glargine [origine ADNr] solution injectable, 300U/ml), son insuline basale à durée d'action prolongée en une prise par jour pour améliorer le contrôle de la glycémie chez l'adulte atteint de diabète de type1 et de type2. Toujeo ® devrait être disponible aux États-Unis au début du 2 ème trimestre de 2015. […].
Second Sight annonce les premiers implants commerciaux du système de prothèse rétinienne Argus® II en France
Second Sight Medical Products, Inc., le 24/02/2015 : En 2014, Argus II est devenu le premier appareil médical à bénéficier du programme Forfait Innovation, permettant ainsi à une sélection d’hôpitaux en France d’offrir un « accès précoce » à ce traitement innovant pour les patients souffrant d’une RP à un stade avancé. Forfait Innovation fournit un support dédié aux patients ayant reçu l’implant Argus II, finançant les coûts de l’implantation et les frais d’hospitalisation des patients. 36 patients atteints de RP en France peuvent désormais bénéficier de cette technologie déterminante avec cette première étape de remboursement national. […].
Sanofi et Regeneron annoncent la publication dans The New England Journal of Medicine des résultats à 18 mois de l'étude ODYSSEY LONG TERM consacrée à Praluent(TM) (alirocumab)
Sanofi, le 15/03/2015 : - Réduction significative et uniforme du taux de LDL-C avec Praluent TM dans le plus important essai en double aveugle, contrôlé par placebo, jamais consacré à un inhibiteur anti-PCSK9 à ce jour - - Moins d'accidents cardiovasculaires majeurs observés avec Praluent TM d'après les résultats de l'analyse post hoc - ) […].
Sanofi annonce les premières données d'une étude sur les résultats cardiovasculaires de Lyxumia® (lixisénatide)
Sanofi, le 19/03/2015 : Paris, France - Le 19 mars 2015 - Sanofi annonce aujourd'hui les premiers résultats de l'étude ELIXA de phase IIIb qui a évalué la tolérance cardiovasculaire de lixisénatide comparativement à un placebo chez des adultes atteints de diabète de type 2 à risque cardiovasculaire élevé. Cette étude a démontré la non-infériorité de lixisénatide par rapport au placebo en termes de tolérance cardiovasculaire, sans toutefois donner la preuve de sa supériorité. […].
The Medicines Company reçoit l’approbation de la Commission européenne pour trois produits de soins hospitaliers actifs : KENGREXAL™ (cangrelor), ORBACTIV® (oritavancine) et RAPLIXA™ (poudre hémostatique)
The Medicines Company, le 03/04/2015 : « L’EEE compte une population de plus de 500 millions de personnes. L’obtention de l’autorisation de mise sur le marché pour ces trois produits de soins actifs nous ouvre la voie, à nous et à nos partenaires, à l'amélioration potentielle des soins à de nombreux patients d'hôpitaux européens. Nous sommes reconnaissants aux autorités des États membres, à l’Agence européenne des médicaments et à la Commission européenne pour leurs examens et approbations opportuns de nos soumissions », a déclaré Clive Meanwell, MD, PhD, Président du conseil et Chef de la direction de The Medicines Company. […].
ESPERITE (ESP) valide SERENITY, le test de dépistage du risque de cancer du sein et des ovaires, qui séquence l'intégralité des gènes BRCA1 et BRCA2 et détecte tous les variants.
Esperite N.V., le 14/04/2015 : SERENITY, détection précoce de la prédisposition génétique au cancer du sein et des ovaires, largement accessible en Europe dés fin mai. […].