Cancer du pancréas : une trithérapie anti-KRAS efface les tumeurs chez la souris, la clinique reste à construire
À retenir (lecture rapide)
• La combinaison daraxonrasib (RMC-6236) afatinib SD36 obtient une régression complète de PDAC murins, sans résistance observée pendant >200 jours.[1]
• La trithérapie verrouille trois axes : aval RAF1, amont EGFR, voie de secours STAT3, pour limiter les échappements biologiques.[1]
• Le CNIO temporise : « aún no estamos en condiciones de llevar a cabo ensayos clínicos con la triple terapia » ; certaines molécules ne sont pas prêtes pour l’administration chez l’humain.[2][9]
• Des essais chez l’humain d’inhibiteurs de KRAS montrent déjà un signal de survie, mais la résistance reste le frein majeur.[9]
Une maladie à très mauvais pronostic, tirée vers le haut par l’incidence
Le PDAC reste l’une des tumeurs solides les plus redoutables, en partie parce qu’il est souvent diagnostiqué à un stade avancé et qu’il concentre des mécanismes d’échappement rapides sous traitement. En France, l’incidence estimée en 2023 s’établit à 15 991 nouveaux cas (8 323 hommes, 7 668 femmes).[3] Plusieurs analyses font état d’une progression régulière dans les pays occidentaux, sur des causes encore discutées (facteurs de risque métaboliques, expositions, vieillissement, amélioration du diagnostic). Pour replacer ce signal dans le paysage français : https://www.caducee.net/actualite-medicale/16401/la-hausse-inquietante-de-l-incidence-du-cancer-du-pancreas.html[6]
Sur le plan thérapeutique, l’arrivée de médicaments ciblant KRAS a ouvert une voie après des décennies dominées par des schémas de chimiothérapie, mais l’obstacle réapparaît presque systématiquement : la résistance finit par se reconstituer, parfois en quelques semaines ou mois, via des contournements de signalisation.[1][9] C’est précisément ce verrou biologique que l’étude de PNAS entend desserrer en rendant l’échappement statistiquement plus difficile.[1]
Une stratégie de contournement… du contournement
La logique proposée s’articule autour de trois leviers, conçus comme complémentaires.
D’abord, daraxonrasib (RMC-6236), présenté comme un inhibiteur de KRAS de classe RAS(ON), destiné à perturber la signalisation pilotée par KRAS lorsque la protéine est dans un état actif.[1] Ensuite, afatinib, inhibiteur irréversible de la famille EGFR/HER2 (EGFR, récepteur du facteur de croissance épidermique ; HER2, récepteur 2 du facteur de croissance épidermique humain), déjà approuvé dans certains cancers pulmonaires et utilisé ici pour couper une remontée de signalisation « amont » susceptible d’alimenter la tumeur malgré l’inhibition de KRAS.[4][9] Enfin, SD36, un PROTAC (chimère de ciblage de protéolyse) sélectif de STAT3 (Signal Transducer and Activator of Transcription 3), visant la dégradation de cette protéine et donc la neutralisation d’une voie alternative de survie tumorale ; à ce stade, il n’a pas encore été testé chez l’humain.[9]
Le papier déroule un raisonnement en deux temps. Sur le plan génétique, l’inactivation de trois nœuds distincts — RAF1 (aval), EGFR (amont) et STAT3 (voie dite orthogonale) — conduit à une « complete and permanent regression » de tumeurs PDAC orthotopiques induites par KRAS/TP53.[1] Sur le plan pharmacologique, la trithérapie transpose cette intuition en ciblant ces trois axes, avec l’ambition explicite de prévenir l’apparition de clones résistants.[1]
Pour rappel, le CNIO souligne que KRAS est muté chez environ 90 % des personnes atteintes d’un cancer du pancréas, ce qui explique l’attrait — mais aussi la fragilité — d’une cible très fréquente dont l’inhibition isolée s’expose à la sélection de voies de secours.[2] À ce titre, STAT3 est depuis longtemps décrit comme un acteur de survie et de prolifération dans plusieurs cancers ; en contexte : https://www.caducee.net/actualite-medicale/5397/des-derives-de-l-indirubine-pourraient-inhiber-la-croissance-de-certains-cancers.html[8]
Des résultats précliniques marquants, devenus viraux
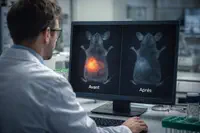
La séquence médiatique a été alimentée par une vidéo largement partagée sur les réseaux sociaux, accompagnée de commentaires enthousiastes, selon Le Figaro Santé.[9] Sur le plan scientifique, le résultat le plus frappant tient en une phrase de l’abstract : la combinaison « induced the complete regression of orthotopic PDAC tumors » avec « no evidence of tumor resistance for over 200 d posttreatment ».[1] L’étude rapporte des effets concordants dans des modèles murins génétiquement modifiés et dans des xénogreffes dérivées de patients (PDX, patient-derived xenografts), utilisées pour se rapprocher de la diversité des tumeurs humaines.[1]
Dans ce cadre, Le Figaro Santé qualifie les résultats de « preuve de concept » et souligne que les scientifiques ont réussi non seulement à faire régresser ou disparaître les tumeurs, mais aussi à prévenir la résistance, avec « aucune reprise » observée « pendant plus de 200 jours après le traitement ».[9]
« Cette durée est exceptionnelle chez la souris. »[9]
La question de la tolérance n’est pas secondaire : elle conditionne tout projet de transposition. Dans sa veille Nota Bene Cancer du 8 décembre 2025, l’Institut national du cancer (INCa) insiste sur ce point : « This triple combination is well tolerated in mice ».[4] Les médias grand public qui ont relayé ces données fin janvier et début février 2026 ont repris cet élément, tout en rappelant le caractère strictement préclinique de l’approche.[5][9]
Résistance : le talon d’Achille des approches anti-KRAS en clinique
Le papier de PNAS vise un objectif central : empêcher la repousse sous pression thérapeutique, en verrouillant simultanément plusieurs circuits de compensation.[1] L’intérêt de cette orientation est aussi clinique. Le Figaro Santé rappelle qu’en 2021, « une nouvelle classe de médicaments » bloquant l’action de KRAS a été identifiée, et cite Yvan Martineau :[9]
« Les premiers résultats des essais chez l’homme indiquent une nette augmentation du temps de survie, avec une toxicité réduite par rapport aux chimiothérapies classiques. »[9]
La même analyse nuance cependant le signal : « le bénéfice clinique reste très limité » en raison du développement de résistances, avec reprise de croissance après « quelques semaines ou mois ».[9]
La clinique, un chantier plus long qu’un titre accrocheur
Les auteurs eux-mêmes, comme l’institution qui les héberge, posent une borne claire. Dans un communiqué du 27 janvier 2026, le CNIO cite Mariano Barbacid : « Nous ne sommes pas encore en mesure de mener des essais cliniques avec la trithérapie. »,[2] certaines molécules « n’étant pas libres de droit ni prêtes à l’administration chez l’homme ».[9] Autrement dit : la preuve de concept existe, mais le « traitement » n’existe pas encore au sens clinique.
Trois séries d’obstacles se dessinent déjà pour les équipes de recherche translationnelle.
Tolérance humaine et schémas d’administration
Afatinib dispose d’un historique clinique en oncologie, mais son association à un inhibiteur de KRAS et à un PROTAC de STAT3 soulève des questions très concrètes : quelles doses cumulées, quelle séquence (concomitante ou séquentielle), et quelle marge de manœuvre face aux toxicités attendues ? Le bon profil chez la souris ne prédit pas mécaniquement la tolérance chez l’humain, notamment en raison de différences d’exposition, de métabolisme et de susceptibilité tissulaire.[1]
Sélection des patients et biomarqueurs
Le PDAC est hétérogène, tant par ses altérations (KRAS/TP53 et au-delà) que par son microenvironnement stromal et immunitaire. Une trithérapie ciblée, si elle arrive en clinique, pourrait nécessiter un tri rigoureux des patients pour éviter un signal « dilué ». Cette nécessité de personnalisation rejoint d’autres travaux : [7]
Développement, propriété intellectuelle et dynamique des essais
Le papier mentionne des dépôts de brevets autour d’une « triple combined therapy inhibiting EGFR, RAF1 and STAT3 ».[1] Il signale aussi, dans les déclarations d’intérêts, l’existence d’une dynamique d’essais autour de RMC-6236, ce qui témoigne d’un écosystème déjà en mouvement, même si la combinaison complète, elle, reste à optimiser avant toute étude chez l’humain.[1]
Un horizon clinique pensé comme une stratégie de réduction de masse tumorale
« Toutes les recherches actuelles ont pour but d’obtenir une réponse très forte, avec une diminution importante de la masse tumorale sans récidive. Cela devrait permettre d’augmenter le nombre de patients opérables par chirurgie et de gagner petit à petit des mois de vie. »[9]
La prudence demeure néanmoins la règle, notamment dans un champ où la reproductibilité des succès murins se heurte souvent au réel :
« Dans le domaine du cancer du pancréas, la plupart des résultats positifs obtenus sur des souris ne sont que très rarement confirmés chez l’homme. »[9]
L’oncologue concède toutefois que la durée sans récidive « a tout de même de quoi donner de l’espoir ».[9]
Une boussole conceptuelle plus qu’un traitement prêt à prescrire
Au total, la valeur immédiate de ce travail est moins de promettre une nouvelle ligne thérapeutique à court terme que de proposer une stratégie : si l’inhibition isolée de KRAS est contournée, alors l’efficacité durable passera probablement par des combinaisons capables de couper simultanément plusieurs voies de secours. Dans le PDAC, où le besoin médical demeure massif, cette approche offre un cadre de réflexion robuste, à condition de ne pas confondre régression murine et bénéfice clinique.[1][2]
Références
1. PNAS — A targeted combination therapy achieves effective pancreatic cancer regression and prevents tumor resistance — mise en ligne le 02/12/2025, publication 09/12/2025. https://www.pnas.org/doi/10.1073/pnas.2523039122
2. CNIO — El grupo de Barbacid en el CNIO elimina tumores de páncreas en ratones por completo y sin que aparezcan resistencias — 27/01/2026. https://www.cnio.es/noticias/el-grupo-de-barbacid-en-el-cnio-elimina-tumores-de-pancreas-en-ratones-por-completo-y-sin-que-aparezcan-resistencias/
3. Santé.fr (information proposée par l’Institut national du cancer) — Cancers du pancréas : les points clés — publié le 04/07/2023. https://www.sante.fr/cancers-du-pancreas-les-points-cles
4. Institut national du cancer (INCa) — A targeted combination therapy achieves effective pancreatic cancer regression and prevents tumor resistance — Nota Bene Cancer, bulletin n°668, 08/12/2025. https://www.cancer.fr/professionnels-de-sante/veille/nota-bene-cancer/bulletin-n-668-du-8-decembre-2025/a-targeted-combination-therapy-achieves-effective-pancreatic-cancer-regression-and-prevents-tumor-resistance
5. Live Science — New triple-drug treatment stops pancreatic cancer in its tracks, a mouse study finds — 30/01/2026. https://www.livescience.com/health/cancer/new-triple-drug-treatment-stops-pancreatic-cancer-in-its-tracks-a-mouse-study-finds
6. Caducee.net — La hausse inquiétante de l'incidence du cancer du pancréas — 03/09/2024. https://www.caducee.net/actualite-medicale/16401/la-hausse-inquietante-de-l-incidence-du-cancer-du-pancreas.html
7. Caducee.net — Cancer du pancréas : un test moléculaire ouvre la voie à la personnalisation des chimiothérapies — 14/03/2023. https://www.caducee.net/actualite-medicale/16054/cancer-du-pancreas-un-test-moleculaire-ouvre-la-voie-a-la-personnalisation-des-chimiotherapies.html
8. Caducee.net — Des dérivés de l'indirubine pourraient inhiber la croissance de certains cancers — 19/04/2005. https://www.caducee.net/actualite-medicale/5397/des-derives-de-l-indirubine-pourraient-inhiber-la-croissance-de-certains-cancers.html
9. Le Figaro Santé — Delphine Chayet, « Une piste très encourageante » : un traitement contre le cancer du pancréas fait ses preuves chez la souris — 03/02/2026 (PDF transmis). https://sante.lefigaro.fr/medecine/une-piste-tres-encourageante-un-traitement-contre-le-cancer-du-pancreas-fait-ses-preuves-chez-la-souris-20260201
Descripteur MESH : Pancréas , Tumeurs , Espagne , Croissance , Patients , Survie , Papier , Essais , Thérapeutique , Incidence , Temps , Santé , Facteur de croissance épidermique , Récidive , Propriété , Propriété intellectuelle , Travail , Écosystème , Vie , Logique , Recherche , Lecture , Personnes , Hommes , Femmes , Expositions , Brevets , France , Face , Association , Maladie , Diagnostic , Pronostic , Risque , Facteurs de risque , Orientation , Caractère , Famille , Intuition , Science , Pression , Protéolyse , Métabolisme , Vieillissement , Talon , Mouvement , Chimère , Génétique

