Les opérateurs économiques sous le règlement relatif aux dispositifs médicaux (RDM) : un partage des obligations de conformité tout au long de la chaîne d’approvisionnement pour renforcer la sécurité des patients
Le récent report de la date limite du RDM de l’UE jusqu’au 26 mai 2021 est donc une évolution bienvenue pour l’industrie, car elle offre aux entreprises une année supplémentaire pour se préparer et assurer que leurs produits soient en conformité — sans quoi ils seront retirés du marché et inaccessible aux professionnels de santé. À ce jour, un certain nombre de fabricants sont toujours dans le processus d’identification de leurs OE et de discernement de leurs nouvelles obligations en vertu du règlement. Étant donné les changements importants que représentent ces nouvelles exigences, certaines entités d’OE peuvent avoir besoin de modifier fondamentalement leurs opérations habituelles. Cet article met en évidence les aspects clés de ces nouvelles responsabilités et surtout, souligne l’impact de cette nouvelle réglementation sur le secteur des soins de santé.
Devenir conjointement et solidairement responsables
Alors qu’auparavant la responsabilité de la conformité relative aux dispositifs médicaux relevait principalement des fabricants de dispositifs, le RDM de l’UE étend désormais la responsabilité à d’autres intervenants de l’industrie. En particulier, le concept d’opérateurs économiques introduit de nouvelles exigences pour les importateurs, les distributeurs et les mandataires ainsi que les fabricants. En vertu du nouveau règlement, les OE partagent dorénavant le devoir d’assurer la conformité. Cela signifie également que la non-conformité de l’une des entités pourrait avoir des implications juridiques directes sur les autres OE de la chaîne d’approvisionnement. L’enjeu est donc de taille.
Ces exigences visent à garantir que plusieurs contrôles soient effectués tout au long du processus de mise sur le marché d’un produit, chaque entité servant de contrôle aux autres. Grâce à ce nouveau système règlementaire, les produits arrivant sur le marché auront donc reçu un niveau de contrôle réglementaire plus élevé et une sécurité accrue pour les patients, mais aussi le personnel soignant et toute autre personne susceptible d’utiliser le dispositif.
Cartographier la chaîne d’approvisionnement
Bien que la conformité soit de plus en plus partagée dans le cadre du RDM, les fabricants continueront de jouer un rôle déterminant dans la compréhension et le contrôle de leur chaîne d’approvisionnement. Sans ce niveau de surveillance, ils pourraient risquer leur accès au marché européen. Dans ces cas-là, les professionnels de santé et les patients pourraient observer la disparition de produits qui ont un réel bénéfice pour la santé. Il est donc dans l’intérêt du fabricant d’identifier et d’aider activement ses OE à se conformer pour assurer leur propre accès au marché européen et l’accès des patients aux produits concernés.
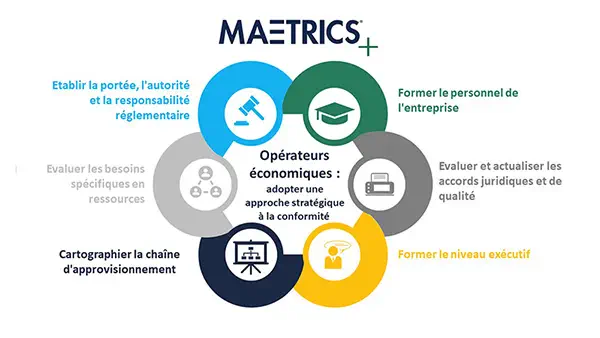
S’ils souhaitent continuer à mettre leurs dispositifs sur le marché de l’UE, les fabricants devront tout d’abord prendre le premier pas vers la conformité : la cartographie de leur chaîne d’approvisionnement et l’identification de chaque entité d’OE telle que définie dans l’Article 2 du RDM. Cette tâche fondamentale servira ultérieurement à évaluer et à confirmer la capacité de leurs opérateurs économiques à respecter leurs obligations.
Identification des importateurs
Les importateurs sont les entités responsables de la mise sur le marché de l’Union européenne des dispositifs d’un pays tiers, comme le stipule l’Article 2 du RDM. Ce groupe a un rôle entièrement nouveau dans la confirmation de la conformité du dispositif médical, et doit maintenant répondre à des exigences réglementaires spécifiques et vérifier les informations du fabricant. Ces responsabilités comprennent la surveillance des rappels de produits, des incidents de vigilance et des produits non conformes. Les importateurs doivent avoir un système en place pour informer le fabricant, le mandataire et l’autorité compétente lorsqu’ils trouvent un produit non conforme. En effet, ce nouveau système de partage des responsabilités permettra de mieux lutter contre les contrefaçons, faciliter les rappels de lots en cas de problème majeur et garantir une sécurité optimale pour les patients tout au long du cycle de vie du dispositif médical.
Trouver les distributeurs
Avant le RDM, les distributeurs n’avaient aucune responsabilité concernant la conformité des dispositifs médicaux qu’ils distribuaient. Une fois le nouveau règlement entré en vigueur en mai 2021, les distributeurs joueront un rôle plus actif. Plus concrètement, les distributeurs devront agir avec la diligence requise et veiller à ce que les conditions de transport et de stockage des produits distribués soient conformes aux règles fixées par le fabricant. Chaque dispositif doit comprendre un mode d’emploi (IFU). De même, ils doivent s’assurer que tous les dispositifs ont un marquage CE, une déclaration de conformité et, une fois implémentés et le cas échéant, l’Identification unique de l’appareil (UDI). Ce durcissement des exigences vise principalement à garantir une meilleure sécurité des dispositifs postérieurement à leur commercialisation.
Placement de produits en dehors des États membres établis
Lorsque les fabricants en dehors de l’Union européenne souhaitent mettre leur produit sur le marché au sein de l’UE, ils doivent désigner un mandataire pour ce faire. Dans le cadre du RDM de l’UE, les mandataires sont qualifiés d’OE et assumeront donc une responsabilité spécifique. Par exemple, les mandataires doivent vérifier que le fabricant ait respecté les obligations d’enregistrement et établir une condition de résiliation du mandat si le fabricant agit contrairement aux obligations.
EUDAMED
Enfin, les fabricants, les mandataires et les importateurs doivent tous se préparer à être enregistrés dans EUDAMED (base de données européenne sur les dispositifs médicaux), ou dans un système d’enregistrement pour OE alternatif jusqu’à sa mise en œuvre intégrale. Une fois en place, la base de données EUDAMED apportera la transparence nécessaire au secteur de la santé, permettant aux différents acteurs de suivre les données de vigilance et de recevoir des alertes importantes.
À l’évidence, un meilleur suivi de ces dispositifs permettra un meilleur contrôle et donc une meilleure sécurité vis-à-vis de ces dispositifs mis au service des professionnels de santé et des patients. Si les fabricants ne prennent pas dès maintenant la transition en main avec une vision stratégique et proactive de la situation, cela pourrait avoir un réel impact sur les services de soin de santé qui dépendent de ces produits.
Notre dernier livre blanc fournit plus de détails sur les nouvelles responsabilités des opérateurs économiques requises par le RDM de l’UE. Téléchargez une copie gratuite du document Maetrics ici : http://bit.ly/2SU1nlx

Descripteur MESH : Sécurité , Santé , Patients , Soins , Rôle , Mandataire , Base de données , Membres , Main , Solutions , Compréhension , Secteur des soins de santé , Vie

