Vous êtes dans : Accueil > Actualités médicales >
Pharmacocinétique
107 résultats triés par date
affichage des articles n° 1 à 19
Selon des études présentées lors de la réunion de l'American Association of Cancer Research, XMT-1107, le deuxième produit candidat au développement de Mersana, exhibe une activité pharmacocinétique et anti-tumorale supérieure
PR Newswire, le 20/04/2009 : CAMBRIDGE, Massachusetts, April 20 /PRNewswire/ -- Mersana, une société de traitements anti-cancéreux basés sur une plate-forme, a annoncé aujourd'hui les résultats positifs des études pré-cliniques menées sur XMT-1107, son deuxième produit candidat au développement, lors de la présentation de deux posters à l'occasion de la réunion 2009 de l'American Association of Cancer Research (AACR) qui s'est tenue à Denver. […].
Cyprotex lance la nouvelle gamme de produits Cloe(R) Select, un portefeuille de services personnalisés d'ADME et de pharmacocinétique
PR Newswire, le 02/04/2008 : MACCLESFIELD, Angleterre, April 2 /PRNewswire/ -- Aujourd'hui (2 avril 2008), Cyprotex a annoncé le lancement d'une nouvelle ligne de produits : Cloe(R) Select. Cloe(R) Select est un portefeuille d'études sur mesure qui peuvent être personnalisées en fonction des besoins de chaque client. Cette ligne de produits complète la gamme actuelle d'essais Cloe(R) Screen et permettra d'offrir des solutions d'ADME (absorption, distribution, métabolisme et excrétion) et de pharmacocinétique à partir de la découverte initiale jusqu'aux phases de développement plus avancées des projets. Tout comme Cloe(R) Screen, la ligne de produits Cloe(R) Select est conforme aux critères imposés par les directives de réglementation, ce qui permet à la clientèle d'avoir constamment confiance en la qualité des données. […].
Le SB8, candidat biosimilaire du bévacizumab validé en phase 3
SAMSUNG BIOEPIS, le 08/10/2019 : Dans une étude de phase 3, le SB8 a fait preuve d’une efficacité équivalente en matière de risque relatif du taux de réponse global (TRG) par rapport au médicament de référence du bévacizumab AVASTIN® i chez les patients atteints d’un cancer du poumon non à petites cellules (CPNPC) non squameux récidivant ou métastasique. La sécurité, la pharmacocinétique et l’immunogénicité étaient également comparables. […].
Mersana Therapeutics annonce les résultats d'une étude de Phase I sur XMT-1001 chez des patients atteints de tumeurs solides, lors de la Conférence internationale du AACR-NCI-EORTC
PR Newswire, le 24/10/2007 : CAMBRIDGE, Massachusetts, October 24 /PRNewswire/ -- Mersana, une société spécialisée dans les traitements anticancéreux, a annoncé les résultats intérimaires d'une étude de Phase I sur son principal produit candidat, XMT-1001, chez des patients atteints de tumeurs solides avancées. Les données ont été présentées par Edward A. Sausville, M.D., Ph.D, professeur de médecine et directeur associé de recherche clinique au Centre anticancéreux Greenebaum de l'Université du Maryland, dans une présentation par affiche faite le 23 octobre lors de la Conférence internationale du AACR-NCI-EORTC 2007 sur les thérapies et les cibles moléculaires qui se tient à San Francisco, en Californie. Le texte complet de l'extrait #A146 « A Phase I Study of the Safety, Tolerability, and Pharmacokinetics of Intravenous XMT-1001 in Patients with Advanced Solid Tumors » (Etude de Phase I sur l'innocuité, la tolérabilité et la pharmacocinétique de XMT-1001 par voie intraveineuse chez des patients atteints de tumeurs solides) peut être consulté en ligne sur le site Web de l'AACR à l'adresse http://www.aacr.org. XMT-1001 est un promédicament polymère de la camptothécine (CPT), un inhibiteur de la topoisomérase I bien caractérisé qui présente une activité anti-tumorale. […].
ESBATech annonce la conclusion réussie de l'étude clinique de phase I sur leur fragment d'anticorps principal développé pour des indications ophtalmiques
PR Newswire, le 08/09/2008 : ZURICH, Suisse, September 8 /PRNewswire/ -- ESBATech AG, leader du développement de thérapies à base de fragments d'anticorps, a annoncé aujourd'hui qu'elle avait complété avec succès son étude clinique de phase I portant sur le principal produit candidat de la société, l'ESBA105, pour des indications ophtalmiques. En avril 2008, ESBATech a entrepris l'étude de phase I dont l'objectif était d'évaluer l'innocuité, la tolérabilité et le profil pharmacocinétique de l'ESBA105, lorsqu'il était administré par voie topique sous forme de gouttes ophtalmiques chez des bénévoles en bonne santé. Cet essai a été mené sous forme d'une étude progressive à dose unique et à doses répétées en Suisse. L'ESBA105 est un fragment d'anticorps monocaténaires dirigé contre les TNF-alpha, et est développé pour des indications ophtalmiques. Plusieurs autres études cliniques en sont dans leurs phases de préparation. […].
La société de biotechnologie BIOCAD annonce le lancement d'essais cliniques Phase 2 de son médicament innovant pour traiter le psoriasis sévère.
BIOCAD, le 13/10/2016 : L'objectif principal de l'étude internationale multicentre, en double aveugle, contrôlée par placebo, est d'évaluer l'efficacité de diverses doses sous-cutanées de BCD-085 chez les patients atteints de psoriasis sévère. L'objectif secondaire est d'évaluer l'innocuité du médicament et la pharmacocinétique. […].
Terns Pharmaceuticals va présenter des données précliniques positives sur l’agoniste du FXR TERN-101 à la réunion The Liver Meeting® 2019
Terns Pharmaceuticals, Inc., le 16/10/2019 : Le résumé (n°2158), intitulé « Pharmacocinétique, distribution tissulaire et pharmacodynamique du TERN-101, un nouvel agoniste du récepteur Farnesoid X (FXR), dans des espèces précliniques » sera présenté sur affiche le lundi 11 novembre 2019. […].
L'ail diminue la concentration plasmatique du saquinavir
Caducee.net, le 06/12/2001 : Les interactions pharmacologiques entre médicaments et compléments nutritifs ou extraits de plantes posent de réels problèmes, surtout aux Etats-Unis. D'après de nouveaux travaux, des comprimés à base d'ail peuvent modifier la pharmacocinétique du saquinavir, inhibiteur de protéase utilisé dans la prise en charge du VIH. Ceci se traduit par une diminution marquée de la concentration en saquinavir chez les patients. […].
La société Aegera Thérapeutique débute l'essai clinique de phase 1 sur son composé AEG33773, une micromolécule en développement pour traiter la douleur neuropathique
PR Newswire, le 18/03/2008 : MONTRÉAL, March 18 /PRNewswire/ -- Aegera Thérapeutique a annoncé aujourd'hui le début d'une étude clinique de Phase 1 sur AEG33773 administré pour la première fois à des sujets humains. AEG33773 est une micromolécule assimilable oralement en développement pour traiter la neuropathie diabétique douloureuse. L'étude de Phase 1 randomisée, double aveugle, contrôlée par placebo, servira à évaluer l'innocuité, la tolérabilité et le profil pharmacocinétique de ce composé administré en dose croissante à des volontaires mâles en santé. […].
BioDuro et le National Center for Safety Evaluation of Drugs ont reçu la pleine accréditation AAALAC
PR Newswire, le 18/04/2008 : BEIJING, April 18 /PRNewswire/ -- BioDuro et le National Center for Safety Evaluation of Drugs (NCSED, ci-après dénommé le « Centre »), à Beijing, ont annoncé la réception de la pleine accréditation AAALAC. BioDuro et le Centre collaborent pour offrir une toxicologie préclinique et une importante expérimentation animale DMPK (pharmacocinétique, toxicocinétique, métabolisme) à leurs clients dans le monde entier. […].
Orcrist Bio Inc. soumet une demande auprès d'une autorité compétente européenne pour un essai ouvert de phase I sur l'innocuité de HYC750 administré en dose croissante
PR Newswire, le 09/02/2009 : CALGARY, Canada, February 9 /PRNewswire/ -- Orcrist Bio Inc. (ORC), une société de biotechnologie consacrée à la mise au point de produits pharmaceutiques pouvant mobiliser des cellules souches, a annoncé aujourd'hui avoir déposé une demande auprès des autorités compétentes européennes de Séville, en Espagne, pour un essai ouvert de phase I portant sur l'innocuité de HYC750 administré en dose croissante chez des bénévoles hommes en bonne santé. L'objectif de cette étude est d'évaluer l'innocuité, la tolérabilité et les profils pharmacocinétique et pharmacodynamique (induction de l'hématopoïèse) de HYC750, une préparation brevetée d'hyaluronane. ORC a utilisé l'expérience et le savoir-faire de Kinesis Pharma BV (Breda, Pays-Bas) en matière de réglementation pour préparer cette demande d'essai clinique. L'étude prévue devrait être menée par InPEC BV (Breda, Pays-Bas) dans leur site d'essai clinique situé à Malaga, en Espagne. […].
Les études mondiales SWIFT évalueront l'innocuité et l'efficacité de Biostate(R) de CSL Behring dans le traitement de la maladie de von Willebrand et de l'hémophilie A
PR Newswire, le 04/02/2010 : ÉDIMBOURG, Écosse, February 4 /PRNewswire/ -- CSL Behring a annoncé aujourd'hui le début du programme d'essai clinique mondial SWIFT (études avec le facteur von Willebrand [FvW]/facteur VIII) pour évaluer la pharmacocinétique, l'efficacité et l'innocuité de Biostate(R), un concentré de facteur FvW/FVIII dérivé du plasma à faible volume hautement efficace pour le traitement de la maladie de von Willebrand (MvW) et l'hémophilie A. La méthodologie employée pour ces essais multicentriques a été présentée en détail aujourd'hui, lors d'une conférence donnée dans le cadre du 3e congrès annuel de l'European Association of Haemophilia and Allied Disorders (EAHAD). […].
La publication des premières données humaines révèle l'innocuité et l'efficacité du tigilanol tiglate sur les tumeurs solides
QBiotics Group Ltd, le 11/12/2019 : Les objectifs principaux de cet essai ouvert de phase I, mono-bras, non randomisé et de recherche de dose consistaient à déterminer le profil d'innocuité, la tolérance, la pharmacocinétique et l'efficacité préliminaire antitumorale du tigilanol tiglate en administration unique par voie intratumorale. D'une manière générale, le tigilanol tiglate a été bien toléré et les doses sont passées de 0,06 à 3,60 mg/m2, sans atteindre de dose maximale tolérée. […].
EirGenix achève l'essai clinique de phase 1 de son deuxième biosimilaire EG1206A contre le cancer du sein
PRNEWSWIRE, le 03/05/2023 : TAIPEI, 4 mai 2023 /PRNewswire/ -- EirGenix, Inc. (6589.TT) a annoncé le 28 avril avoir terminé en Europe l'essai clinique de phase 1 (EGC101) de son deuxième biosimilaire contre le cancer du sein EG1206A. En comparant EG1206A à Perjeta® de Roche aux États-Unis et dans l'Union européenne, les résultats de l'analyse des données cliniques montrent que les principaux indicateurs d'essai ont satisfait à la norme de bioéquivalence pharmacocinétique. EG1206A est un médicament biosimilaire de l'anticorps HER2 de deuxième génération Perjeta® (pertuzumab). EG1206A a un mécanisme unique de liaison pour les récepteurs HER2 qui peut produire un double effet de blocage. En association avec le trastuzumab, un anticorps HER2 de première génération, le pertuzumab a un effet synergique dans le traitement du cancer du sein au stade précoce HER2-positif et du cancer du sein métastatique. […].
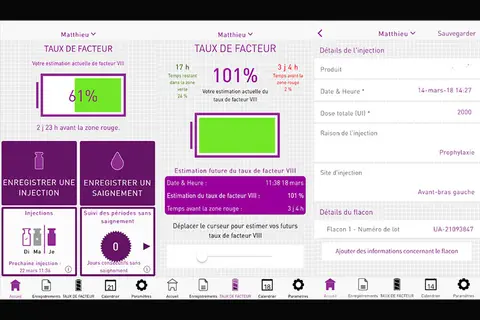
Pour une prise en charge personnalisée du patient hémophile, Shire lance l’application myPKiT
SHIRE, le 15/11/2018 : Après la mise à disposition du dispositif médical myPKFiT en septembre 2016 auprès des professionnels de santé, Shire lance l’application mobile myPKFiT (aussi qualifiée de dispositif médical) destinée aux patients hémophiles A avec l’objectif d’un monde sans saignement. Cette application permet notamment au patient d’améliorer sa compréhension de sa propre couverture hémostatique et des risques associés, en fonction de l’estimation de son taux de facteur VIII et de ses activités. Plus impliqué dans la décision thérapeutique, le patient participe davantage à sa prise en charge, devient plus autonome et pourrait donc être plus observant. […].
Mersana annonce les résultats préliminaires de la Phase 1 de l'étude des effets du XMT-1001 sur des patients atteints de tumeurs solides avancées
PR Newswire, le 01/06/2009 : CAMBRIDGE, Massachusetts, June 2 /PRNewswire/ -- Mersana Therapeutics a présenté les résultats de la Phase 1 de l'essai clinique de son principal produit candidat, le XMT-1001, lors d'une présentation à la réunion annuelle 2009 de l'American Society of Clinical Oncology (ASCO) à Orlando. XMT-1001 est un agent cytotoxique à large spectre d'efficacité, basé sur la camptothécine (CPT) et conjugué à la plate-forme de polymère biodégradable de Mersana, le Fleximer(R). […].
Hémophilie A : SHIRE lance ADVATE MYPKFIT un logiciel médical pour optimiser le traitement par ADVATE
SHIRE, le 28/02/2017 : Le laboratoire Shire annonce la mise à disposition depuis octobre 2016 en France de myPKFiT (1), un logiciel médical, spécifiquement conçu pour personnaliser le traitement par facteur VIII dans l’hémophilie A, ainsi que le préconisent les recommandations françaises et internationales. Ce dispositif médical, qui a obtenu un marquage CE, permet de choisir le schéma posologique le plus adapté chez les patients avec une hémophilie A traités par ADVATE®, facteur VIII recombinant de coagulation humain, commercialisé en 2004 et prescrit à de nombreux patients dans le monde. […].
Les nouvelles données montrent une non-infériorité d'efficacité pour la formulation sous-cutanée de CT-P13 (infliximab biosimilaire) par rapport à la formulation intraveineuse de CT-P13 chez les personnes atteintes d'arthrite rhumatoïde
Celltrion Healthcare, le 09/11/2019 : Les personnes ayant reçu des doses complètes de CT-P13 IV 3 mg/kg aux semaines 0 et 2 ont été placées aléatoirement dans un groupe recevant soit du CT-P13 SC 120 mg par seringue préremplie deux fois par semaine (de la semaine 6 à la semaine 28), soit du CT-P13 IV 3mg/kg toutes les 8 semaines (de la semaine 6 à la semaine 22). À partir de la semaine 30, toutes les personnes ont reçu du CT-P13 SC 120 mg par seringue préremplie deux fois par semaine jusqu'à la semaine 54.1 […].