Vous êtes dans : Accueil > Actualités médicales >
Maladies rares
147 résultats triés par date
affichage des articles n° 73 à 91
Ipsen et Exelixis annoncent les résultats de l’étude de phase 3 avec le cabozantinib démontrant un bénéfice significatif en termes de survie globale chez des patients atteints de carcinome hépatocellulaire avancé précédemment traité
Ipsen, le 16/01/2018 : Ipsen (Euronext : IPN ; ADR : IPSEY) et Exelixis, Inc. (NASDAQ : EXEL) ont annoncé aujourd’hui les résultats détaillés de l’étude pivot de phase 3 CELESTIAL chez des patients atteints de carcinome hépatocellulaire (HCC) avancé précédemment traité. Ils seront présentés lors d’une session orale « late-breaking » dans le cadre du Symposium 2018 de l’ASCO-GI qui se tiendra à San Francisco du 18 au 20 janvier 2018. Dans l’étude CELESTIAL, le cabozantinib a démontré une amélioration statistiquement significative de la survie globale (OS) et cliniquement pertinente, par rapport au placebo, critère d'évaluation principal, lors de la deuxième analyse intermédiaire prévue (valeur p critique prédéfinie ≤ 0,021) pour la population de patients en seconde et troisième lignes de traitement inclus dans l’étude. L’OS médiane était de 10,2 mois avec le cabozantinib contre 8,0 mois avec le placebo (HR 0,76, IC 95 % 0,63-0,92 ; p=0,0049). La survie sans progression (PFS) médiane avait plus que doublé, atteignant 5,2 mois avec le cabozantinib et 1,9 mois avec le placebo (HR 0,44, IC 95 % 0,36-0,52 ; p […].
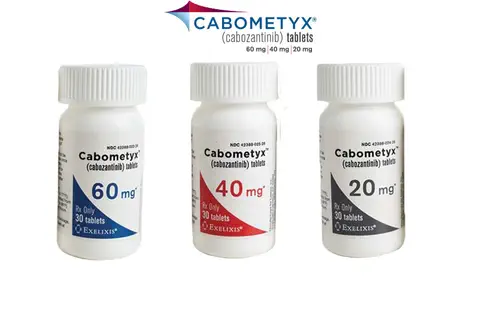
Cancer du rein avancé : CABOMETYX® (cabozantinib) bientôt disponible
Caducee.net, le 30/01/2018 : La filiale française d’Ipsen (Euronext: IPN; ADR: IPSEY) annonce la publication prochaine au Journal Officiel pour CABOMETYX® (cabozantinib) dans le cadre de son Autorisation de Mise sur le Marché (AMM) de son inscription sur la liste des spécialités remboursables aux assurés sociaux ainsi que sur la liste des spécialités agréées à l’usage des collectivités. […].
Pfizer lance une étude clinique en thérapie génique expérimentale (mini-dystrophine) avec un premier patient atteint de myopathie de Duchenne.
PFIZER, le 03/05/2018 : Pfizer a lancé une étude clinique de phase 1b afin d'évaluer son candidat de thérapie génique (mini-dystrophine), le PF-06939926, chez des garçons atteints de myopathie de Duchenne ou DMD (dystrophie musculaire de Duchenne). Le 22 mars 2018, un premier patient a reçu par administration intraveineuse un mini-gène de la dystrophine (ou mini-dystrophine), sous le contrôle d'Edward Smith, MD, investigateur principal de l'étude et Professeur Agrégé en pédiatrie et neurologie au centre médical de la Duke University. La sélection et l'inclusion des patients vont se poursuivre dans quatre centres de recherche clinique aux États-Unis. Les premières données de cette étude devraient être communiquées au cours du premier semestre 2019, après l'évaluation de tous les patients prévue un an après l'administration du traitement. […].
Ipsen annonce la présentation de nouvelles données cliniques lors de l'ISPRM 2018 démontrant son engagement dans la recherche sur les neurotoxines
Ipsen, le 04/07/2018 : Ipsen (Euronext: IPN ; ADR : IPSEY) a annoncé aujourd'hui que son portefeuille en neurotoxines ferait l'objet de 13 abstracts lors du 12ème Congrès mondial de l'International Society of Physical and Rehabilitation Medicine (ISPRM), qui se tiendra du 8 au 12 juillet à Paris. […].
Ipsen et BioLabs annoncent l’ouverture d’un nouveau centre d'innovation à Cambridge (Etats-Unis) pour favoriser le développement de nouveaux traitements pour les patients
Ipsen, le 19/07/2018 : Ipsen, groupe biopharmaceutique mondial focalisé sur l’innovation et la médecine de spécialité, a annoncé aujourd’hui un partenariat avec BioLabs pour l’ouverture d’un espace de travail partagé dédié aux sciences de la vie, au sein de son nouveau hub mondial situé en Amérique du Nord, à Kendall Square, Cambridge (Massachusetts). L’ « Ipsen Innovation Center - BioLabs » (IPSEN-ICB) est un nouvel espace collaboratif de 1 400 m2 (15 000 pi2), disposant de bureaux et de laboratoires entièrement équipés, qui a pour but de soutenir des entrepreneurs et des startups qui développent la prochaine génération de traitements pour les patients. […].
Emmaus Life Sciences annonce que le New England Journal of Medicine a publié les résultats de l'essai de Phase 3 sur Endari™ (L-glutamine en poudre administrée par voie orale) contre la drépanocytose
Emmaus Life Sciences, Inc., le 19/07/2018 : L'article fournit les résultats ayant démontré une réduction de 25 pour cent du nombre de crises drépanocytaires chez les patients recevant Endari, comparé à ceux recevant un placebo ; p=0,005 (médian 3 versus médian 4) et une nette réduction de 33 pour cent du nombre d'hospitalisations ; p=0,005 (médian 2 versus médian 3). Les conclusions supplémentaires ont fait état d'une réduction de 41 pour cent des jours cumulés à l'hôpital ; p=0,02 (médian 6,5 jours versus médian 11 jours), et une réduction de plus de 60 pour cent de l'incidence de syndrome thoracique aigu (STA) ; p=0,003 (13 patients sur 152 [8,6 %] ont présenté au moins un STA, comparé à 18 des 78 dans le groupe placebo [23,1 %]). Les effets indésirables les plus communs (plus de 10 pour cent des cas) de l'étude clinique ont été la constipation, la nausée, la céphalée, la douleur abdominale, la toux, la douleur aux extrémités, la douleur dorsale et la douleur thoracique. […].
Myalepta®▼ approuvé en Europe : le premier traitement indiqué pour les patients atteints d’une maladie très rare, la lipodystrophie
Aegerion Pharmaceuticals, le 09/08/2018 : Aegerion Pharmaceuticals a annoncé aujourd’hui que la Commission européenne a approuvé l’autorisation de mise sur le marché en Europe de Myalepta (métréleptine). Myalepta est un traitement pour la lipodystrophie, une maladie très rare, et a été approuvé en tant que traitement de substitution en complément d’un régime alimentairepour le traitement des complications du déficit en leptine chez les patients atteints de lipodystrophie. Grâce à cette autorisation, Myalepta devient le premier et le seul médicament autorisé pour traiter le déficit en leptine sous-jacent au cœur de cette pathologie très rare. […].
Bristol-Myers Squibb abaisse à 12 ans l’age d’inclusion dans ses essais cliniques précoces en immuno-oncologie
BMS, le 04/09/2018 : Bristol-Myers Squibb a décidé d’ouvrir ses essais cliniques précoces d’immunothérapie dès l’âge de 12 ans, afin de permettre aux adolescents atteints de cancer d’avoir accès aux traitements innovants en développement au même moment que les patients adultes. […].
Ipsen présente les résultats de la première étude sur l'homme d'une neurotoxine recombinante à action rapide (rBoNT-E) au Congrès TOXINS 2019
Ipsen, le 17/01/2019 : Les résultats de la première étude chez l'homme d'une neurotoxine recombinante seront présentés lors de la conférence internationale TOXINS 2019 qui se tiendra à Copenhague (Danemark). La neurotoxine botulique recombinante de sérotype E (rBoNT-E) d'Ipsen a été étudiée dans le cadre d'une étude de phase I qui a caractérisé son profil de sécurité et de tolérance chez des volontaires sains1. L'étude a également démontré qu'elle agissait plus rapidement et moins longtemps que les neurotoxines botuliques de type A existantes, et que son pic d'action était atteint plus rapidement. D'autres études seront menées pour établir les utilisations esthétiques et thérapeutiques potentielles de ce traitement expérimental. […].
La téléexpertise désormais facturable à l’assurance maladie par les médecins
Caducee.net, le 10/02/2019 : À partir du 10 février, les médecins pourront facturer directement à leur caisse d’assurance maladie les services de téléexpertise qu’ils auront sollicités auprès d’un confrère médecin pour s’assurer d’une prise en charge plus rapide de leur patient. Accessible à tous les médecins, cette procédure est limitée pour le moment à certaines catégories de patient, mais devrait être généralisée à partir de 2020. […].
Jubilant Biosys renforce sa collaboration avec Sanofi dans le domaine thérapeutique du système nerveux central
Jubilant Biosys Limited, le 13/02/2019 : BANGALORE, Inde, February 13, 2019 /PRNewswire/ --Jubilant Biosys, une filiale de Jubilant Life Sciences basée à Bangalore, a annoncé aujourd'hui une nouvelle collaboration intégrée avec Sanofi dans le domaine thérapeutique du système nerveux central. La première collaboration avec Sanofi a débuté en 2016, en vue de découvrir et de mettre au point des inhibiteurs de petites molécules pour des cibles multiples du domaine thérapeutique des troubles métaboliques. […].
Mallinckrodt annonce les résultats provisoires de l'analyse de l'essai clinique de phase 3 de la plate-forme Therakos® dans le cadre du traitement des patients pédiatriques atteints de maladie grave du greffon contre l'hôte réfractaire aux stéroïdes
Mallinckrodt plc, le 21/02/2019 : -- Le taux de réponse global a dépassé l'objectif de point médian spécifié pour l'étude (n = 25) et l'entreprise choisit d'arrêter le recrutement d'autres patients comme le permet le protocole -- […].
Takeda présentera un portefeuille croissant et diversifié de produits oncologiques lors de prochains congrès scientifiques
Takeda Pharmaceutical Company Limited, le 20/05/2019 : « Nous sommes impatients de présenter à l'ASCO et à l'AEH des données qui illustrent les progrès continus de notre portefeuille – aussi bien dans le cadre de la recherche clinique qu'en situation réelle – pour les tumeurs solides et les cancers du sang », a déclaré Phil Rowlands, Ph.D., responsable de l’unité thérapeutique Oncologie chez Takeda. « Ces données démontrent notre engagement constant à l'égard de la découverte, du développement et de la distribution de médicaments pour les patients atteints de cancers. » […].
Zolgensma : le médicament à 2 millions de dollars en vente aux États-Unis
Caducee.net, le 27/05/2019 : Le Zolgensma est un médicament de thérapie génique dont la commercialisation par Novartis a été approuvée par la Food and Drug Administration américaine le 24 mai dernier. Il traite en une prise l’amyotrophie spinale infantile qui était encore incurable il y a quelques années. S’il s'agit d’une avancée médicale indéniable que l’AFM qualifie d’historique, son prix de vente fixé à plus de 2 millions de dollars en fait le médicament le plus cher au monde. De quoi alimenter la méfiance envers les BIG PHARMA ? […].
Takeda fournit une mise à jour pour l'essai TOURMALINE-AL1 de Phase 3 sur l'amyloïdose AL
Takeda Pharmaceutical Company Limited, le 06/06/2019 : "Bien que déçus par ce résultat, notre objectif est d'optimiser les conclusions tirées de cet essai et d'en partager les conclusions avec la communauté dans l'espoir d'améliorer les soins pour les patients vivant avec cette maladie dévastatrice", a déclaré Phil Rowlands, Ph.D., chef de l'unité des thérapies oncologiques chez Takeda. "Il s'agit là de l'une des plus vastes études sur l'amyloïdose AL à chaînes légères systémique jamais réalisées, et nous sommes fiers de l'avoir pilotée. Cette étude témoigne de notre engagement à l'égard de cette population de patients rare et généralement difficile à recruter, et nous remercions patients et chercheurs pour leurs efforts et leur participation. Nous restons optimistes à propos de NINLARO et poursuivons nos recherches sur ce composant auprès des populations de patients de l'ensemble du continuum de soins du myélome multiple," a-t-il ajouté. […].
Objets connectés : Abbott et Sanofi s’associent pour transformer la prise en charge du diabète
SANOFI & ABBOTT, le 16/09/2019 : Abbott et Sanofi nouent une collaboration pour intégrer les technologies de mesure de la glycémie et d’administration d’insuline afin de simplifier davantage la manière dont les patients atteints de diabète prennent en charge leur maladie. Les deux entreprises vont mobiliser leurs capacités d’innovation en matière de soins connectés pour développer des outils combinant la technologie révolutionnaire FreeStyle Libre aux données sur le dosage de l’insuline dans de futurs stylos intelligents et applications de dosage de l’insuline, ainsi que dans un logiciel cloud. […].
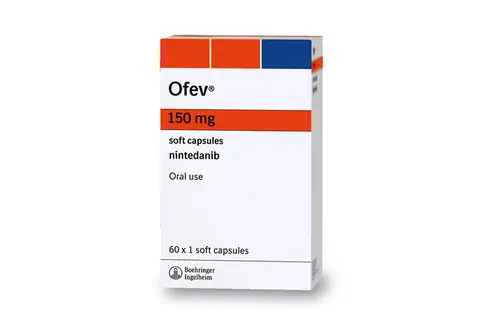
Pneumopathie interstitielle diffuse : INBUILD® atteint son critère d’évaluation principal dans une étude de phase 3
Boehringer Ingelheim , le 07/10/2019 : Boehringer Ingelheim a annoncé aujourd’hui que dans l’étude de phase III INBUILD®, le nintédanib avait ralenti le déclin de la fonction pulmonaire de 57 % sur l’ensemble de la population de l’étude, évalué par le taux annuel de déclin de la capacité vitale forcée (CVF) a sur 52 semaines chez des patients atteints de pneumopathie interstitielle diffuse (PID) fibrosante avec des signes de progression.1 L’étude, qui vient d’être publiée dans le New England Journal of Medicine et présentée au congrès de l’ERS à Madrid, Espagne, a atteint son critère d’évaluation principal et étudié l’efficacité et la tolérance du nintédanib chez les patients atteints de diverses formes de pneumopathies interstitielles diffuses fibrosantes progressives autres que la fibrose pulmonaire idiopathique (FPI) .1 […].
Le trastuzumab deruxtecan (DS-8201) obtient de la FDA le statut d’évaluation prioritaire pour le traitement du cancer du sein métastatique HER2 positif
Daiichi Sankyo Company, Limited, le 18/10/2019 : Aux termes de la Loi sur les droits d’utilisation des médicaments sur ordonnance (Prescription Drug User Fee Act, PDUFA), la date d’évaluation du trastuzumab deruxtecan, un conjugué anticancéreux (antibody drug conjugate, ADC) expérimental ciblant l’anticorps HER2 dans le traitement des patientes atteintes d’un cancer du sein métastatique HER2 positif, est fixée au premier trimestre de l’exercice 2020. […].