Vous êtes dans : Accueil > Actualités médicales >
Anticorps
725 résultats triés par date
affichage des articles n° 523 à 541
La peste
C.Perbet, Dr L.Jeannin, le 15/10/2001 : La peste a donné lieu à de grandes épidémies historiques et est considérée aujourd'hui comme une maladie réémergente dans le Monde, c'est une maladie à déclaration obligatoire soumise au règlement Sanitaire International. L'Organisation Mondiale de la Santé rapporte chaque année 1 000 à 3 000 cas de peste dans le Monde. Elle est encore présente sous forme de foyers sauvages dans certaines régions d'Iran (Kurdistan), en Inde, Afghanistan, Azerbaïdjan, Russie centrale, Chine, Viet Nam, Afrique de l'Est (Kenya), Madagascar, Amérique du Sud (Brésil), Ouest des Etats-Unis qui pourraient exposer à de nouvelles flambées épidémiques. […].
La leptospirose
E.Faure, le 10/08/2015 : Dossier de synthèse caducee.net sur la leptospirose : la leptospirose est une maladie à déclaration obligatoire provoquée par la Leptospira... […].
La leptospirose
E.Faure, le 10/08/2015 : Dossier de synthèse caducee.net sur la leptospirose : la leptospirose est une maladie à déclaration obligatoire provoquée par la Leptospira... […].
La rubéole
E.Faure, le 15/10/1999 : Le point complet sur la rubéole : . […].
La rubéole
E.Faure, le 15/10/1999 : Le point complet sur la rubéole : . […].
Les allergies alimentaires
EUFIC, le 01/01/2000 : Les études montrent qu'environ 20% de la population adulte pense souffrir d'allergies alimentaires. Néanmoins, lorsqu'on effectue des recherches, on se rend compte que seul 1 à 2% d'entre eux sont réellement allergiques. Les jeunes enfants ont plus de chances que les adultes de présenter des allergies car leur système immunitaire n'est pas encore parfaitement développé. […].
Les allergies alimentaires
EUFIC, le 01/01/2000 : Les études montrent qu'environ 20% de la population adulte pense souffrir d'allergies alimentaires. Néanmoins, lorsqu'on effectue des recherches, on se rend compte que seul 1 à 2% d'entre eux sont réellement allergiques. Les jeunes enfants ont plus de chances que les adultes de présenter des allergies car leur système immunitaire n'est pas encore parfaitement développé. […].
La biotechnologie moderne et la qualite des aliments
EUFIC, le 01/01/2000 : La première utilisation du génie génétique, il y a vingt ans, a ouvert la voie pour bien d'autres progrès dans le domaine de la phytogénétique comme dans celui de la fermen-tation. Alors que chaque pas en avant peut paraître relativement petit, l'ensemble pourraient bien se traduire par de nouvelles améliorations de la qualité nutritive, de l'aspect, de la saveur, de la commodité, du prix et de la sécurité de consommation des aliments. […].
La biotechnologie moderne et la qualite des aliments
EUFIC, le 01/01/2000 : La première utilisation du génie génétique, il y a vingt ans, a ouvert la voie pour bien d'autres progrès dans le domaine de la phytogénétique comme dans celui de la fermen-tation. Alors que chaque pas en avant peut paraître relativement petit, l'ensemble pourraient bien se traduire par de nouvelles améliorations de la qualité nutritive, de l'aspect, de la saveur, de la commodité, du prix et de la sécurité de consommation des aliments. […].
Un vaccin contre les caries
EUFIC, le 01/01/2000 : D'après un article paru récemment dans la revue Nature Medicine, et aussi étonnant que cela puisse paraître, c'est à partir de plants de tabac génétiquement modifiés que des scientifiques britanniques viennent de mettre au point un vaccin efficace contre les caries dentaires. Quatre mois d'essais fructueux sur des patients permettent de penser que le traitement pourrait être mis à la disposition du public d'ici quelques années. […].
Un vaccin contre les caries
EUFIC, le 01/01/2000 : D'après un article paru récemment dans la revue Nature Medicine, et aussi étonnant que cela puisse paraître, c'est à partir de plants de tabac génétiquement modifiés que des scientifiques britanniques viennent de mettre au point un vaccin efficace contre les caries dentaires. Quatre mois d'essais fructueux sur des patients permettent de penser que le traitement pourrait être mis à la disposition du public d'ici quelques années. […].
L'intégration des services a un impact sur les coûts
FIH, le 01/01/2000 : Ajouter le traitement des MST à la PF peut rendre les services plus accessibles tout en réduisant leur coût. […].
L'intégration des services a un impact sur les coûts
FIH, le 01/01/2000 : Ajouter le traitement des MST à la PF peut rendre les services plus accessibles tout en réduisant leur coût. […].
Réduire le risque de transmission du VIH de la mère à l'enfant
FIH, le 01/01/2000 : Dans le monde entier, entre un quart et un tiers des enfants nés de femmes infectées par le VIH deviennent eux-mêmes infectés.1 Cette transmission du virus de la mère vers l'enfant, appelée transmission "verticale" ou "périnatale", est la principale cause d'infection du VIH chez le nouveau-né. […].
Réduire le risque de transmission du VIH de la mère à l'enfant
FIH, le 01/01/2000 : Dans le monde entier, entre un quart et un tiers des enfants nés de femmes infectées par le VIH deviennent eux-mêmes infectés.1 Cette transmission du virus de la mère vers l'enfant, appelée transmission "verticale" ou "périnatale", est la principale cause d'infection du VIH chez le nouveau-né. […].
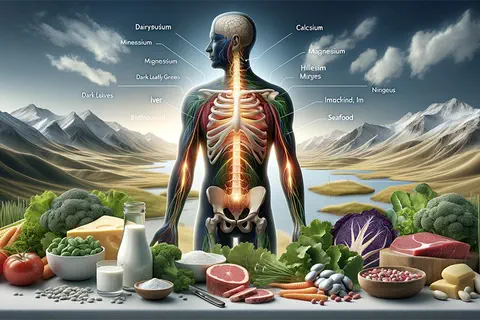
Les sels minéraux et les oligo-éléments : des nutriments clés pour la pratique clinique
Caducee.net, le 01/07/2024 : Les sels minéraux et oligo-éléments sont essentiels à de nombreux processus physiologiques et jouent un rôle central dans la santé humaine. Bien qu'ils ne fournissent aucune énergie, ils sont indispensables au fonctionnement normal des systèmes enzymatiques, neuromusculaires et hormonaux. Cet article propose un aperçu complet destiné aux professionnels de la santé sur les rôles, les besoins, et les sources alimentaires des sels minéraux et oligo-éléments, ainsi que les conséquences cliniques des carences ou excès. […].
Les sels minéraux et les oligo-éléments : des nutriments clés pour la pratique clinique
Caducee.net, le 01/07/2024 : Les sels minéraux et oligo-éléments sont essentiels à de nombreux processus physiologiques et jouent un rôle central dans la santé humaine. Bien qu'ils ne fournissent aucune énergie, ils sont indispensables au fonctionnement normal des systèmes enzymatiques, neuromusculaires et hormonaux. Cet article propose un aperçu complet destiné aux professionnels de la santé sur les rôles, les besoins, et les sources alimentaires des sels minéraux et oligo-éléments, ainsi que les conséquences cliniques des carences ou excès. […].
MSD annonce une étude positive évaluant l’utilisation de pembrolizumab par rapport à la chimiothérapie chez les patients avec des mélanomes avancés et réfractaires au traitement par ipilimumab
MSD, le 17/11/2014 : Ces conclusions, y compris les analyses prédéterminées du taux de réponse global (ORR), de la durée de réponse, de l’innocuité et de la qualité de vie liée à la santé (QDVS), ont été présentées aujourd’hui lors d’une session orale au Congrès international 2014 de la Society of Melanoma Research (SMR) à Zurich, Suisse, par le Dr Antoni Ribas, professeur d’hématologie/oncologie et de chirurgie, et directeur du Programme d’immunologie des tumeurs au Jonsson Comprehensive Cancer Center de l’Université de Californie, à Los Angeles. […].